Exazerbationen bei COPD
Interessengebiete: Allgemeinmedizin und Innere Medizin, Geriatrie, Pneumologie
Häufig treten bei COPD-Patienten akute Exazerbationen auf, die sich negativ auf die Lebensqualität der Patienten, die Krankheitskosten (Hospitalisierung) und die Prognose auswirken. Der Verhinderung von Exazerbationen bei COPD kommt daher eine klinisch bedeutsame Rolle zu. Neben nicht-medikamentösen Maßnahmen (Rauchverzicht, Steigerung der körperlichen Aktivität, Schutzimpfungen) benötigen COPD-Patienten dazu eine medikamentöse Dauertherapie. COPD-Patienten, die häufig exazerbieren, können von einer inhalativen Kortikosteroid-Therapie (ICS) profitieren. Studienbefunde geben Anlass zu der Annahme, dass die Eosinophilenzahl dabei als Biomarker für das Ansprechen genutzt werden kann.
Kursinhalt
Inhaltsverzeichnis
Einleitung
Häufig treten bei COPD-Patienten akute Exazerbationen auf, die sich negativ auf die Lebensqualität der Patienten, die Krankheitskosten (Hospitalisierung) und die Prognose auswirken. Die Therapie sollte daher u. a. darauf abzielen, Häufigkeit und Schwere der Exazerbationen zu reduzieren sowie die Belastbarkeit und den Gesundheitszustand zu verbessern.
Der Verhinderung von Exazerbationen bei COPD kommt daher eine klinisch bedeutsame Rolle zu.
Die vorliegende CME-Fortbildung gibt einen aktuellen Überblick zur aktuellen Behandlungsstrategie der COPD und macht mit der S2k-Leitlinie von 2018 und den aktualisierten GOLD-Empfehlungen vertraut. Die Fortbildung gibt Hilfestellung für die Langzeit-Therapie mit LABA/LAMA und ICS.
Exazerbationen bei COPD
Die chronisch obstruktive Lungenerkrankung (COPD) ist charakterisiert durch eine persistierende und üblicherweise progrediente Atemwegsobstruktion und entsteht aus einer komplexen Interaktion individueller Faktoren (Genetik, Alter u. a.) und Umweltfaktoren (v. a. Zigarettenrauch). Exazerbationen und Komorbiditäten können den Schweregrad der Erkrankung mitbestimmen [1].
Die COPD-Mortalität ist in den letzten 30–40 Jahren deutlich gestiegen [2]. COPD ist zurzeit die vierthäufigste Todesursache weltweit, und die Vorhersagen der Global Burden of Disease Study gehen davon aus, dass die COPD im Jahr 2020 die dritthäufigste Todesursache sein wird [3].
einer Bevölkerung.
Der Disability-adjusted life years (DALYs)-Score wurde entwickelt, um den spezifischen Anteil einer chronischen Erkrankung an der Gesamtkrankheitsbelastung einer Bevölkerung abschätzen zu können. Es handelt sich um die Summe der Jahre, die durch frühzeitiges Versterben oder krankheitsbedingte Behinderung, verloren gehen [4]. In den USA nimmt die COPD Platz 2 hinsichtlich der Zahl von DALYs ein – nach der ischämischen Herzerkrankung [5].
Exazerbationen als kritische Ereignisse
Häufig treten bei COPD-Patienten akute Exazerbationen auf (Abb. 1) [6, 7, 8]. Die COPD-Exazerbation ist definiert als eine akute, über mindestens 2 Tage anhaltende Verschlechterung der respiratorischen Symptome mit der Notwendigkeit einer Intensivierung der Therapie. Der akuten Exazerbation liegen eine entzündlich bedingte verstärkte Bronchokonstriktion oder eine verstärkte Schleimproduktion mit Überblähung zugrunde. Kernsymptome sind die Zunahme der Dyspnoe (ggf. mit Brustenge), des Hustens, des Sputumvolumens und der Sputumpurulenz [9].
Ein patientengerechter Fragebogen erleichtert das gezielte Erfassen von Exazerbationen im Versorgungsalltag – aktuell oder im zurückliegenden Intervall. Er umfasst 5 Fragen [10].
- Haben sich seit dem letzten Besuch in der pneumologischen Praxis die Symptome Ihrer COPD-Erkrankung zwischenzeitlich deutlich verschlechtert?
- Haben Sie seit dem letzten Besuch in der pneumologischen Praxis wegen einer akuten Verschlechterung Ihrer COPD außerplanmäßig einen Arzt benötigt?
- Hatten Sie seit dem letzten Besuch in der pneumologischen Praxis einen stationären Krankenhausaufenthalt wegen Ihrer COPD?
- Haben Sie seit dem letzten Besuch in der pneumologischen Praxis zwischenzeitlich Ihr inhalatives Medikament häufiger einsetzen oder Ihr Bedarfsmedikament öfter anwenden müssen?
- Haben Sie seit dem letzten Besuch in der pneumologischen Praxis zwischenzeitlich zusätzliche Medikamente zum Einnehmen wegen Ihrer COPD benötigt?
mit Überblähung.
Dieser Monitoring of Exacerbation Probability-Fragebogen (MEP-Score) kann parallel zum etablierten CAT-Fragebogen eingesetzt werden, der nur begrenzt verwertbare Signale für die Detektion von Exazerbationen liefert [11].
Der Schweregrad einer Exazerbation wird mangels definierter klinischer Kriterien auf der Basis der Inanspruchnahme des Gesundheitswesens durch den Patienten beurteilt (sogenannte „Health Care Utilization = HCU“). Es werden unterschieden:
- Leichte Exazerbationen: Sie werden nur mit zusätzlichen Gaben von kurzwirksamen Bronchodilatatoren vom Patienten selbst behandelt und werden dem behandelnden Arzt vom Patienten oft nicht mitgeteilt [12, 13].
- Mittelschwere Exazerbationen: Zunahme der Dyspnoe, des Hustens, des Sputumvolumens und der Sputumpurulenz machen ärztliches Ergreifen erforderlich. In der Regel wird über die Standardmedikation hinaus ein systemisches Glukokortikosteroid und/oder ein Antibiotikum verordnet.
- Schwere Exazerbationen: Diese liegen dann vor, wenn eine stationäre Behandlung angezeigt ist [14].
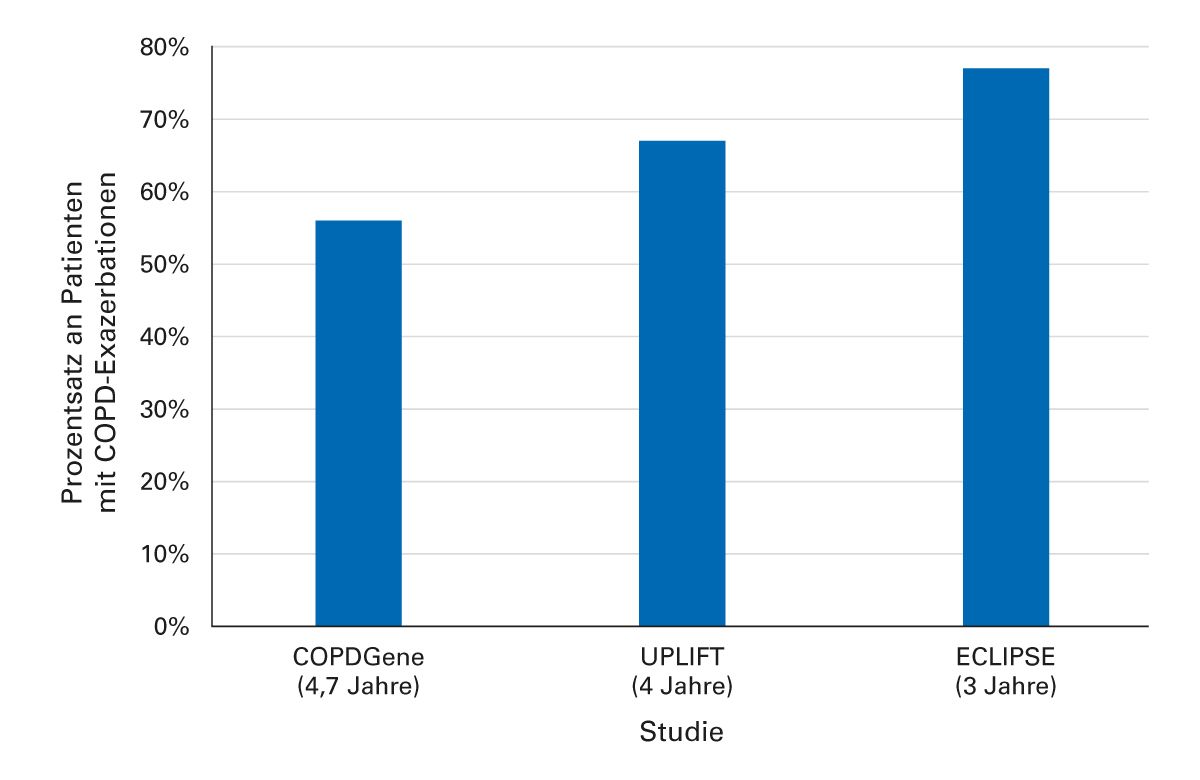
Abb. 1: Die meisten Patienten mit COPD haben mindestens eine Exazerbation innerhalb von 3 Jahren [6, 7, 8].
Die deutsche Leitlinie [9] schlägt darüber hinaus eine Kategorie „sehr schwere Exazerbationen“ vor. Gemeint sind Ereignisse, bei denen eine intensivierte Therapie auf einer Intensivstation oder einer Intermediate Care Unit als erforderlich angesehen wird. Exazerbationen wirken sich negativ auf die Lebensqualität der Patienten, Krankheitskosten (Hospitalisierung) und Prognose aus. Zudem können Exazerbationen langfristig zur Verschlechterung der Lungenfunktion beitragen (Abb. 2) und haben so negative Auswirkungen auf die Progression der COPD [15]. Außerdem erhöht sich mit zunehmender Exazerbationsfrequenz das Risiko nachfolgender schwerer Exazerbationen [16, 17]. Eine britische Studie zeigt für COPD-Exazerbationen eine Krankenhausmortalität von 7 % und eine 90-Tagesmortalität von 15 %. Mehr als 50 % der Patienten, die mit einer COPD- Exazerbation aus dem Krankenhaus entlassen werden, werden innerhalb eines Jahres COPD-bedingt wieder aufgenommen [18]. Zahlen des europäischen COPD-audits bestätigen das im Wesentlichen und zeigen sogar eine Rehospitalisierungsrate von 30 % in den ersten 90 Tagen [19].
Exazerbationen wirken sich negativ auf die Lebensqualität der Patienten, Krankheitskosten (Hospitalisierung) und Prognose aus. Zudem können Exazerbationen langfristig zur Verschlechterung der Lungenfunktion beitragen (Abb. 2) und haben so negative Auswirkungen auf die Progression der COPD [15]. Außerdem erhöht sich mit zunehmender Exazerbationsfrequenz das Risiko nachfolgender schwerer Exazerbationen [16, 17]. Eine britische Studie zeigt für COPD-Exazerbationen eine Krankenhausmortalität von 7 % und eine 90-Tagesmortalität von 15 %. Mehr als 50 % der Patienten, die mit einer COPD- Exazerbation aus dem Krankenhaus entlassen werden, werden innerhalb eines Jahres COPD-bedingt wieder aufgenommen [18]. Zahlen des europäischen COPD-audits bestätigen das im Wesentlichen und zeigen sogar eine Rehospitalisierungsrate von 30 % in den ersten 90 Tagen [19].
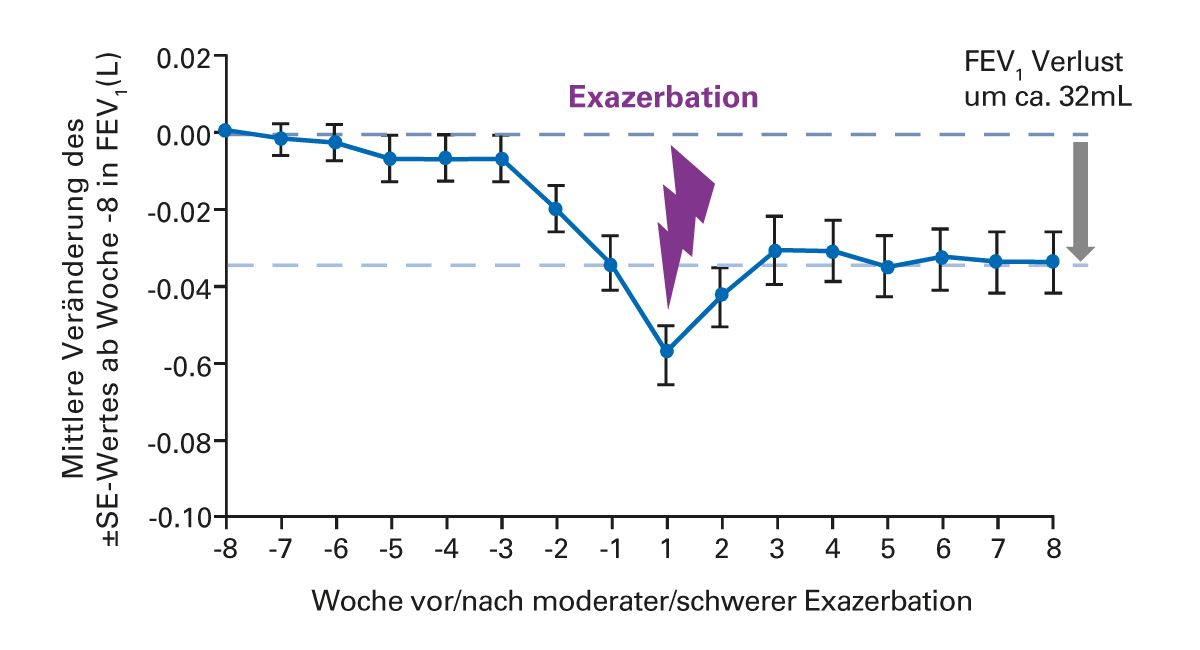
Abb. 2: Bei den meisten Patienten erholt sich die Lungenfunktion nach einer Exazerbation nicht mehr vollständig [15].
Typologie der COPD
In den letzten Jahren mehrte sich die Evidenz dafür, dass in der Vorgeschichte erlittene Exazerbationen und die Symptomatik aussagekräftiger für Charakterisierung und Prognose der COPD sind als spirometrische Befunde [20, 21, 22]. Die aktuellen Leitlinien [4, 9] unterscheiden vier COPD-Gruppen: A, B, C und D (Abb. 3).
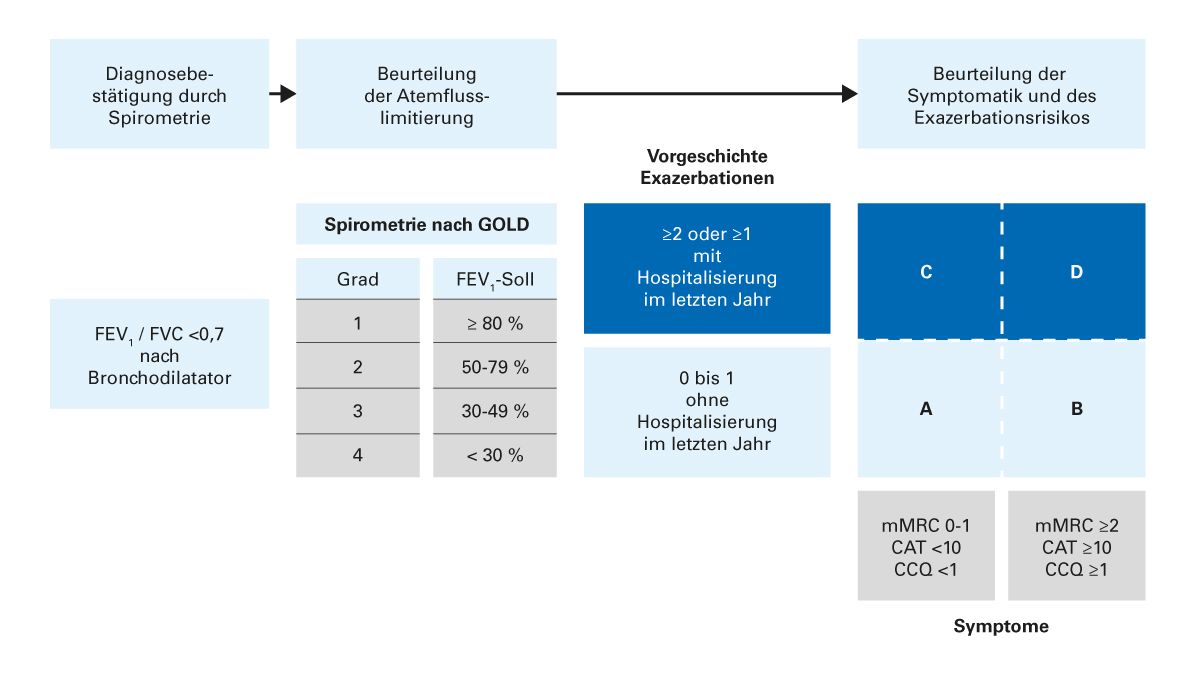
Abb. 3: Exazerbationshäufigkeit und Symptomatik beeinflussen die Schweregradeinteilung der COPD in die Gruppen A-D [4, 9].
Als wenig symptomatisch (Stadium A oder C) gelten die Stufen 0 und 1 der mMRC (modified Medical Research Council)-Skala. Bevorzugt wird jedoch die Anwendung von CAT (COPD Assessment Test)- oder CCQ (COPD Control Questionnaire)-Fragebögen. Beim CAT mit 8 Fragen mit jeweils 0–5 Punkten (völlige Beschwerdefreiheit 0, Maximum Score 8 × 5 = 40) gilt ein Score <10 als wenig symptomatisch. Beim CCQ – 10 Fragen mit jeweils von 0–6 Punkten – wird das Ergebnis noch durch 10 geteilt (völlige Beschwerdefreiheit 0, Maximum Score 10 × 6: 10 = 6). Als wenig symptomatisch gilt hier ein Score von ≤1.
Die Anzahl der Exazerbationen wird anamnestisch erfasst. Mindestens eine stationär behandelte (schwere) oder mindestens zwei ambulant behandelte mittelschwere (Gabe von Antibiotika und/oder systemischen Kortikosteroiden) Exazerbationen, gelten als erhöhtes zukünftiges Risiko und werden den COPD-Stadien C oder D zugeordnet. Patienten mit 0–1 mittelschweren Exazerbationen im Jahr werden in die Stadien A oder B eingeteilt.
Prognostischer Wert von Exazerbationen
Exazerbationen sind der häufigste Grund für Hospitalisierung und Mortalität. Eine britische Studie zeigt aber, dass Patienten mitunter nicht adäquat reagieren. Ein großer Anteil der Patienten wartete mit dem Aufsuchen von ärztlicher Hilfe einfach ab – unabhängig von der Schwere der Exazerbation [23] (Abb. 4). Da sich der Gesundheitszustand nach dem Ereignis wieder bessert (Abb. 5), werden viele Exazerbationen dem behandelnden Arzt nicht mitgeteilt [24, 25]. Hier gehört es zu den Aufgaben der betreuenden Praxis, bei Patienten ein Problembewusstsein zu schaffen, über alle Ereignisse rund um ihre Erkrankung Buch zu führen und zu informieren. Eine strukturierte ärztliche Abfrage kann diesen Prozess unterstützen.
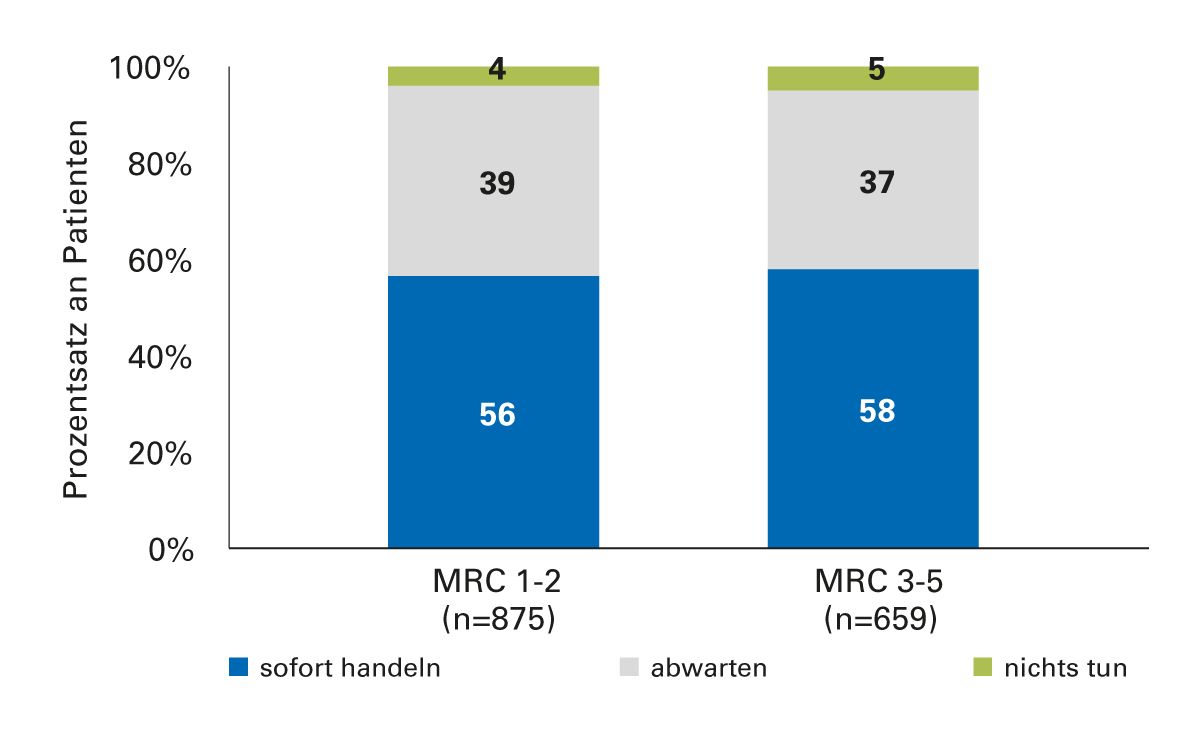
Abb. 4: Viele Patienten unternehmen bei einer Exazerbation zunächst einmal nichts, unabhängig von der Schwere [23].
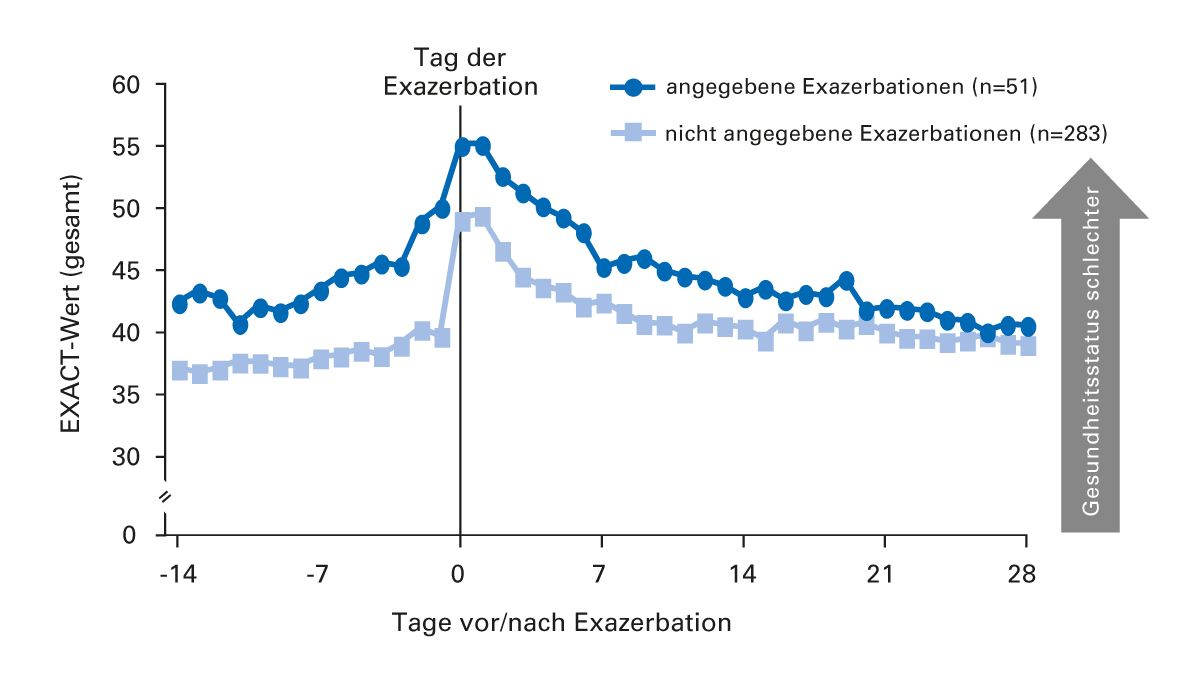
Abb. 5: Typischer Gesundheitsstatus vor, während und nach einer Exazerbation. EXACT = EXAcerbations of COPD Tool [25].
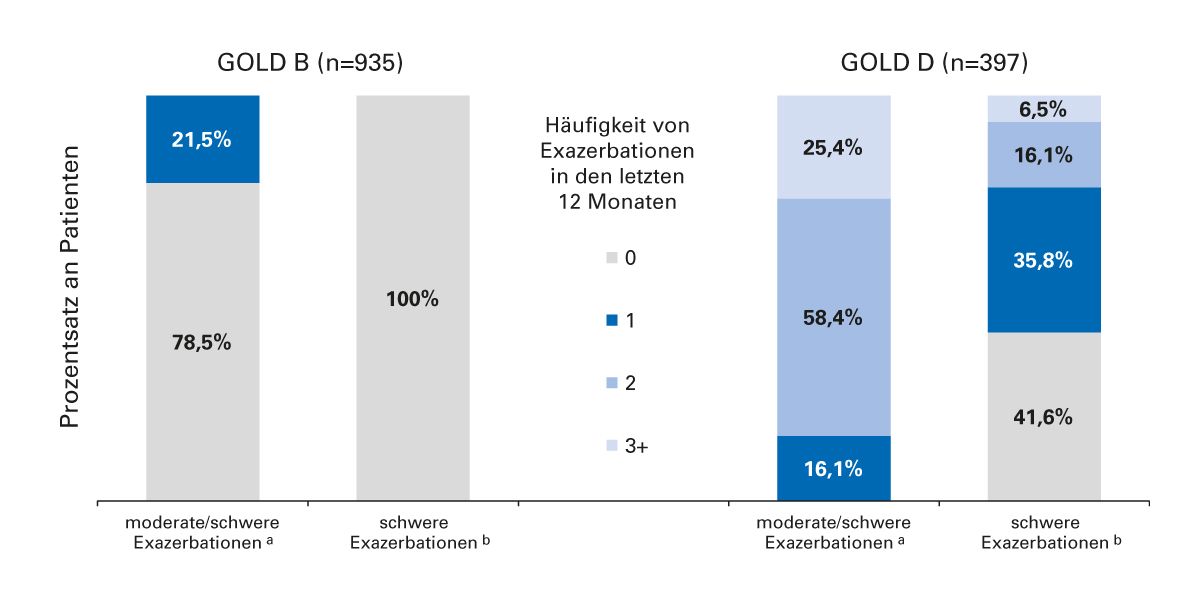
Abb. 6: Während nur ca. 20 % der GOLD B-Patienten im Lauf eines Jahres eine Exazerbation haben, davon keine mit Hospitalisierung, sind alle Patienten der Gruppe D betroffen – die Mehrzahl davon mit Hospitalisierung [26].
z. B. für GOLD D-Patienten bei über 50%.
Neben der symptomatischen Besserung gehört somit die Prävention von Exazerbationen zu den zentralen Behandlungszielen der COPD.
In einer Auswertung der Adelphi Real World Respiratory Disease Specific Program™-Umfrage wurde das Risiko für eine Exazerbation in Abhängigkeit von der Krankheits-Kategorie untersucht und die symptomatisch auffälligen Patienten der Gruppen B und D verglichen [26] (Abb. 6). Fast 80 % der GOLD B-Patienten erlebten während des Untersuchungszeitraums keine Exazerbationen und kein Patient in dieser Gruppe musste hospitalisiert werden. In der GOLD D-Gruppe erlitt ein Viertel der Patienten ≥3 Exazerbationen und 58 % ≥1 schwere Exazerbationen.
Auch eine britische Registerstudie von 2014 mit fast 60.000 Patienten hatte gezeigt, dass die Zahl der Exazerbationen im vergangenen Jahr Rückschlüsse auf die Wahrscheinlichkeit von zukünftigen Exazerbationen erlaubt [27]. Die Häufigkeit der Exazerbationen einzelner Patienten während der 12 Monate vor Beginn der Beobachtung und auch während des 12-monatigen Nachbeobachtungszeitraums wurde in drei Kategorien eingeteilt: 0, 1 oder 2 oder mehr (häufige) Episoden.
Bei 72 % der Patienten, bei denen während der 12-monatigen Nachbeobachtungs- zeit keine Exazerbationen aufgetreten waren, wurde keine mittelschwere bis schwere Exazerbation in den vorangegangenen 12 Monaten festgestellt. 46 % der Patienten, bei denen in der Nachbeobachtungszeit häufige mittelschwere bis schwere Exazerbationen auftraten, hatten in den letzten 12 Monaten zwei oder mehr Exazerbationen (Abb. 7).
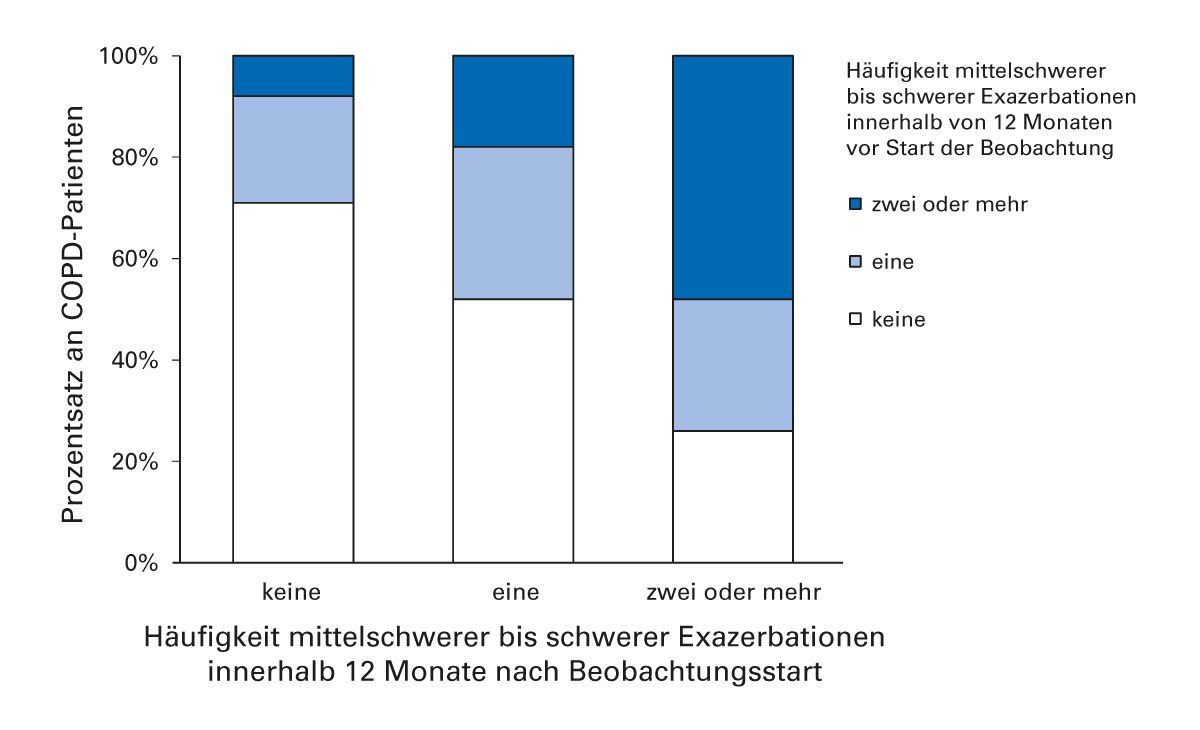
Abb. 7: Die Zahl der Exazerbationen im vergangenen Jahr erlaubt Rückschlüsse auf die Wahrscheinlichkeit von zukünftigen Exazerbationen [27].
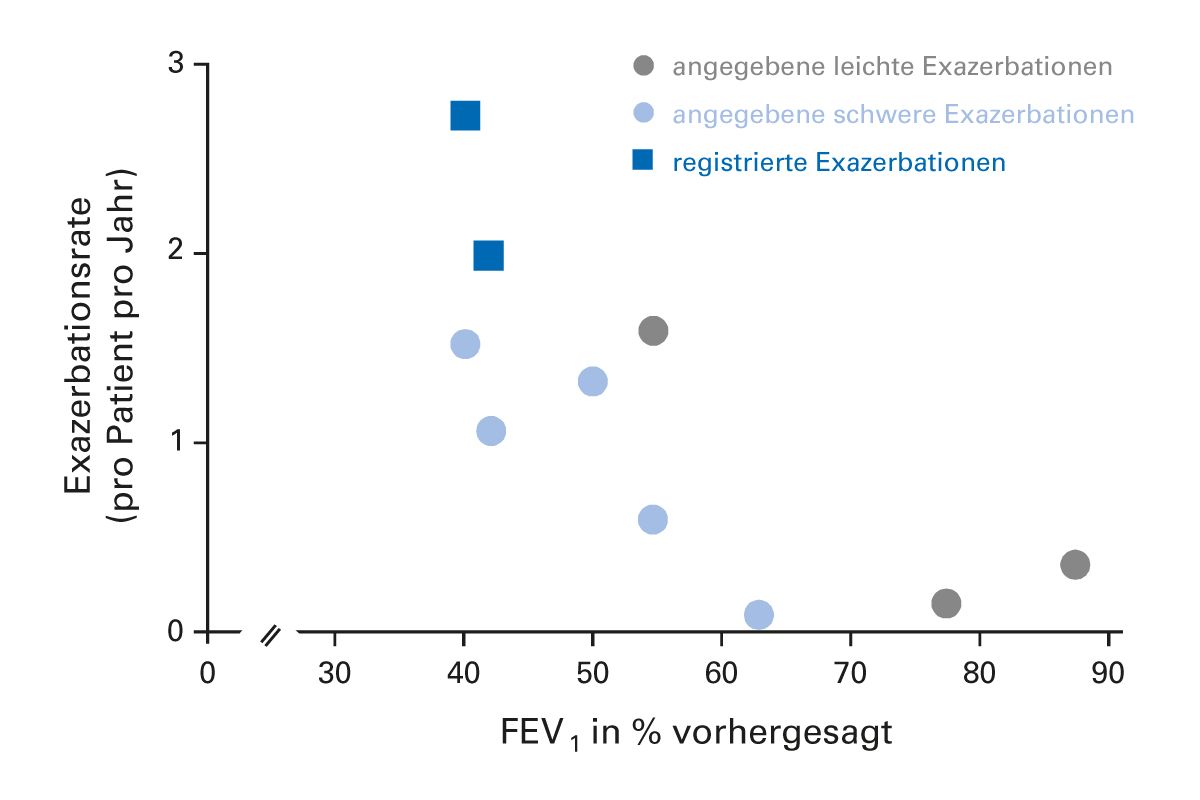
Das Risiko einer Exazerbation steigt dabei mit abnehmender Lungenfunktion. Eine Analyse gemischter Daten aus Kohorten und Gruppen von Patienten, die an verschiedenen klinischen Studien teilnahmen, untersuchte die dokumentierten Exazerbationsraten. Die Daten dieser Analyse legen nahe, dass das Risiko einer Exazerbation mit abnehmender Lungenfunktion steigt [28] (Abb. 8).
Durch die zunehmende Abnahme der Lungenfunktion beschleunigt jede Exazerbation auch die Abnahme der Leistungsfähigkeit und Lebensqualität der Patienten. Schon eine Arbeit von 2010 hatte gezeigt, dass nicht berichtete COPD-Exazerbationen einen bedeutenden negativen Einfluss auf die gesundheitsbezogene Lebensqualität haben [29].
Eine US-amerikanische Studie untersuchte den Zusammenhang zwischen akuten COPD-Exazerbationen und der Veränderung der Lungenfunktion über einen Zeitraum von 5 Jahren [30]. Während der Nachbeobachtungszeit wurden alle 6 Monate Exazerbationen erfasst und die FEV1-Abnahme ermittelt. Den größten Effekt fand man in der Gruppe im Stadium GOLD 1, wo jede Exazerbation mit einem Rückgang von 23 ml/Jahr (95 % -KI 2-44; P = 0,03) und jede schwere Exazerbation mit einer zusätzlichen Abnahme von 87 ml/Jahr (95 % -KI 23-151; P = 0,008) verbunden war. Statistisch signifikante, je- doch geringere Effekte wurden bei Probanden in den GOLD Stadien 2 und 3 beobachtet (Abb. 9).
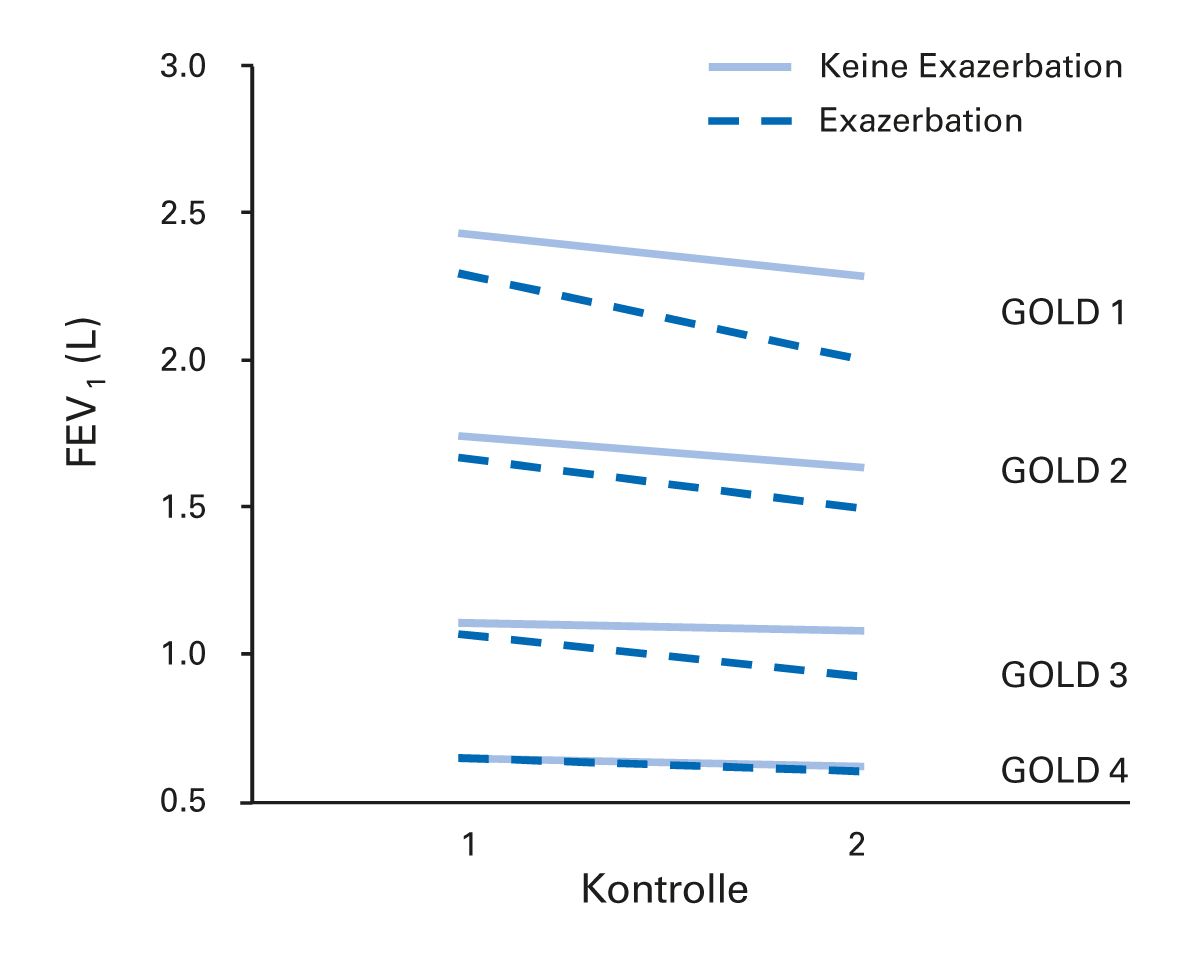
Abb. 9: Patienten mit milder Form der COPD haben einen größeren Verlust an Lungenfunktion nach jeder Exazerbation [30].
Komorbidität und Lebensqualität
COPD tritt vor allem in der Altersgruppe ≥65 Jahre auf. Altersbedingt, sowie bedingt durch die gemeinsame Noxe Rauchen und körperliche Inaktivität, ist COPD häufig mit Begleiterkrankungen wie kardiovaskulären Erkrankungen, metabolischem Syndrom oder mentalen Erkrankungen vergesellschaftet [31].
COPD ist mit einem 2,5-fach höheren Gesamtrisiko für alle kardiovaskulären Erkrankungen assoziiert, wobei die häufigsten Entitäten jeweils ungefähr das gleiche Risiko aufweisen [32]. Es handelt sich um koronare Herzerkrankung mit und ohne stattgehabten Myokardinfarkt, Herzrhythmusstörung, Herzinsuffizienz sowie peripher-arterielle Verschlusskrankheit. Ein Zusammenhang zwischen Lungenüberblähung, reduzierter Herzfüllung und vermindertem Schlag- bzw. Herzzeitvolumen konnte ebenfalls gezeigt wer- den [33, 34]. Für die zerebrovaskulären Erkrankungen ist das Risiko bei COPD-Patienten hingegen nur tendenziell erhöht [32].
Auch bei Exazerbationen sind nicht nur die Atemwege betroffen. So ist das Risiko für einen Myokardinfarkt innerhalb der ersten 5 Tage nach einer Exazerbation verdoppelt und kehrt dann langsam wieder zum Ausgangswert zurück. Das Risiko für einen Schlaganfall ist zwischen dem 5. und 10. Tag nach einer Exazerbation um 40 % erhöht [35]. Jüngere Daten zeigen sogar ein 10-fach erhöhtes Risiko für kardiovaskuläre Ereignisse in den ersten 30 Tagen nach stationär behandelten Exazerbationen [36].
Schon die erste schwere COPD-Exazerbation deutet auf eine schlechtere Prognose bei COPD-Patienten hin. Eine populationsbasierte Kohortenstudie mit mehr als 4.000 COPD- Patienten untersuchte die Mortalität im Krankenhaus und die einjährige Mortalität nach Entlassung. 175 der Patienten (4 %) starben während des Krankenhausaufenthalts und ein Jahr nach der Entlassung waren 22 % (871/4029) der Krankenhausüberlebenden tot (Abb. 10). Alter und Charlson-Komorbiditätsindex waren unabhängige Prädiktoren für die Mortalität nach einem Jahr [37].
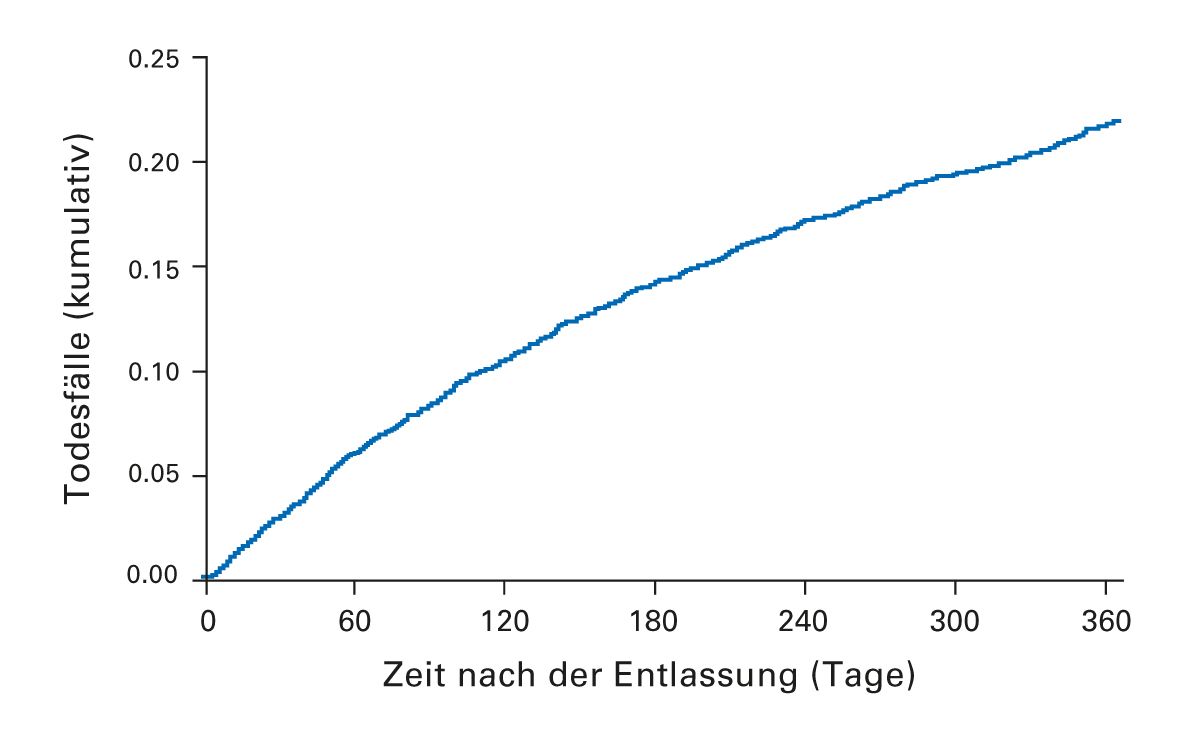
Abb. 10: Exazerbationen erhöhen die Wahrscheinlichkeit für einen vorzeitigen Tod. 22 % der COPD-
Patienten versterben innerhalb von einem Jahr nach ihrer ersten Hospitalisierung [37].
Die aktuellen DMP-Richtlinien gehen deutlich stärker auf die Komorbiditäten ein [38]. Die wichtigsten Komorbiditäten sollten proaktiv diagnostiziert werden, da anamnestische Angaben der Patienten häufig ungenügend sind [39]. Therapeutisch wird in der Behandlung der kardiovaskulären Erkrankungen nicht unterschieden zwischen Patienten mit COPD und ohne COPD [40].
Therapie
Bei der Versorgung der COPD-Patienten, die häufig mehrere Komorbiditäten haben, ist eine effektive interdisziplinäre Zusammenarbeit von Hausärzten, Pneumologen und ggf. Kardiologen essenziell, auch, damit jede akute COPD-Exazerbation früh diagnostiziert und umgehend angemessen therapiert wird. Die oben genannten Daten zur Prognose bei Exazerbationen verdeutlichen das Potenzial, das die Aufklärung und die Anleitung von COPD-Patienten zum frühzeitigen Selbstmanagement einer Exazerbation haben könnten. Real World-Daten aus den USA, Kanada und China zeigen aber, dass zwischen 36–75 % der Patienten nach einer Exazerbation nicht adäquat behandelt werden [41, 42, 43, 44]. So erhielten in einer amerikanischen Studie mit >50.000 Patienten nur 64 % der Patienten mit einer Exazerbation in der Anamnese ein lang wirksames Erhaltungsmedi- kament [42]. Die Therapie sollte daher u. a. darauf abzielen, Häufigkeit und Schwere der Exazerbationen zu reduzieren sowie die Belastbarkeit und den Gesundheitszustand zu verbessern.
Nicht-medikamentöse Therapie
Eine der wichtigsten Maßnahmen ist der Verzicht auf das Rauchen und somit ggf. die Teilnahme an einer Maßnahme zur Nikotinentwöhnung. Durch eine Kombination aus verhaltenstherapeutischen Maßnahmen und einer begleitenden Pharmakotherapie mit Nikotinersatzstoffen und/oder Vareniclin bzw. Bupropion können langzeitige Abstinenzraten von 25 % und mehr erreicht werden [45]. Den Patienten, die im Disease- Management-Programm (DMP) eingeschrieben sind, können Programme zur strukturierten Rauchentwöhnung angeboten werden, deren Wirksamkeit nachgewiesen und dokumentiert ist [46]. COPD-Patienten sollten zudem am Arbeitsplatz vor inhalativen Noxen geschützt werden [47, 48].
Auch die Steigerung der körperlichen Aktivität ist ein wichtiger Baustein, um die Exazerbationshäufigkeit zu senken. Sie gehört zur pneumologischen Rehabilitation, einer am Patienten individuell ausgerichteten Behandlung mit körperlichem Training, Schulung zur Verhaltensänderung und dem Erlernen von Maßnahmen der Selbstbehandlung [49]. Sie kann stationär wie ambulant durchgeführt werden [50, 51] und zur Linderung der Beschwerden, zur Verbesserung der Lebensqualität und der physischen und psychischen Alltagsbewältigung beitragen [52, 53].
Auch Schutzimpfungen spielen eine wichtige Rolle. Die Influenza-Schutzimpfung sollte jährlich bei allen COPD-Patienten mit dem jeweils aktuellen Impfstoff durchgeführt werden. Nach einer Metaanalyse konnte bei sechs der analysierten Studien mit COPD-Patienten eine signifikante Reduktion von Influenza-induzierten Exazerbationen in den ersten 3–4 Wochen nach der Impfung nachgewiesen werden [54]. Die STIKO empfiehlt außerdem eine Indikationsimpfung gegen Pneumokokken bei allen Lungenerkrankungen, so auch bei der COPD [55].
Medikamentöse Therapie
3-fach-Fixkombination, sowie als Bedarfsmedikation zusätzlich SABA.
COPD-Patienten benötigen eine medikamentöse Dauertherapie. Zum Einsatz kommen primär inhalative LABA (Long-Acting Beta-2 Agonist) und LAMA (Long-Acting Muscarinic Antagonist) und abhängig vom Exazerbationsrisiko zusätzlich inhalative Kortikosteroide (ICS), z. B. als 3-fach-Fixkombination. Als Bedarfsmedikation werden üblicher- weise zusätzlich SABA (Short-Acting Beta-2 Agonist) verordnet.
COPD-Patienten, die häufig exazerbieren oder eine zusätzliche asthmatische Komponente aufweisen, können von einer inhalativen Steroidtherapie am meisten profitieren [9]. In Interventionsstudien konnte die Überlegenheit der Triple-Therapie gegenüber Zweifach-Kombinationen bei schwerer COPD demonstriert werden. In der IMPACT-Stu- die, in der COPD-Patienten mit häufigen Exazerbationen untersucht wurden, reduzierte die Triple-Therapie gegenüber der dualen Bronchodilatation das Exazerbationsrisiko um 25 % (0,91 vs. 1,21 pro Jahr). Auch Lebensqualität und Lungenfunktion besserten sich signifikant [56]. Ein ähnliches Ergebnis zeigte sich in der ETHOS-Studie mit über 8.500 COPD-Patienten. Hier reduzierte die Triple-Therapie gegenüber der dualen Bronchodilatation die Rate an moderaten/schweren Exazerbationen um 24% (1,08 vs 1,42 pro Jahr) [65]. Obwohl die Rate an Pneumonie-Ereignissen unter den Triple-Kombinationen höher als unter den LABA/LAMA Kombinationen war (IMPACT 7,6% vs 4,7%; ETHOS 4,6% vs 2,9%) unterstreichen die Effekte auf die Exazerbationsraten die Bedeutung von ICS beim Management von COPD-Patienten mit häufigen Exazerbationen, was nach Erscheinen der FLAME-Studie kontrovers diskutiert worden war [59].
Auch die Studien TRIBUTE [57] und KRONOS [58] zeigten bessere Ergebnisse unter Triple-Therapie im Vergleich zur LABA-LAMA Kombination. Im Gegensatz zu den an- deren Triple-Studien waren Exazerbationen in der Vorgeschichte in KRONOS Patienten kein notwendiges Einschlusskriterium [58]. In KRONOS zeigte die Triple-Kombination (Budesonid/Glycopyrronium/Formoterol) gegenüber der dualen Kombination (Glycopyrronium/Formoterol) über 24 Wochen eine signifikante Verbesserung der Lungenfunktion und der Exazerbationsraten (-52 %, 0,46 vs. 0,95 pro Jahr). Die Triple-Kombination war auch in Bezug auf Lebensqualität und Symptomatik von Vorteil. Hinzuzufügen ist, dass die Triple-Studien in den letzten Jahren eine reduzierte Mortalität im Vergleich zu LAMA, LABA/LAMA oder LABA/ICS gezeigt haben [66, 67, 68, 69]. Im Gegensatz zu früheren Studien zielen die jüngsten Studien auf Patientenpopulationen mit stärkerer Symptomatik und häufigen und/oder schweren Exazerbationen in der Vorgeschichte.
Eosinophile Granulozyten als Biomarker
Die neuen GOLD-Empfehlungen raten erstmals auch dazu, bei COPD die Zahl der eosinophilen Granulozyten im peripheren Blut zu bestimmen [4]. So geben verschiedene Studienbefunde der letzten Jahre Anlass zu der Annahme, dass die Eosinophilenzahl als Biomarker für das Ansprechen auf eine zusätzliche Behandlung mit ICS genutzt werden kann.
So bekräftigte die Studie INCONTROL 1 den Zusammenhang zwischen der Zahl der Eosinophilen und dem Exazerbationsrisiko [60]. Mit steigender Zahl der Eosinophilen im Blut nahm das Risiko für das Auftreten akuter Exazerbationen unter LABA-Therapie (Formoterol) zu, während ICS/LABA (Budesonid/Formoterol) die Exazerbationsrate auf dem Niveau von Patienten mit niedrigen Eosinophilen (bereits ab 100 Zellen/μl) halten konnte (Abb. 11). Auch in IMPACT war der Therapie-Effekt der Triple-Therapie bei Patienten mit einer Eosinophilenzahl von mehr als 100 Zellen/μl erkennbar.
Auch post-hoc-Daten der TRIBUTE-Studie demonstrierten eine Prävention von Exazerbationen durch ICS im Rahmen einer Triple-Therapie ab einer Eosinophilenzahl von 200 Zellen/μl. Analysen aus der KRONOS Studie zeigten ähnlich wie in den beiden anderen Triple-Studien und INCONTROL 1 eine Assoziation zwischen der Zahl der Eosinophilen und einer Verbesserung von Lungenfunktion und COPD-Exazerbationsraten in den beiden Studienarmen mit ICS-Kombinationen.
Konkret wird entsprechend dem GOLD-Report auf Basis der vorliegenden Evidenz nun eine Indikation für die Therapie mit ICS zusätzlich zur Bronchodilatation bei einer Eosinophilenzahl über 300 Zellen/µl gesehen [61] (Abb. 12). Bei vorbehandelten Patienten, die unter LABA/LAMA weiterhin exazerbieren, empfiehlt GOLD die Eskalation zu einer Triple-Therapie (LABA/LAMA/ICS) ab einer Eosinophilenzahl von 100. Aufgrund der Ergebnisse der INCONTROL 1 und Triple-Studien und den Empfehlungen im GOLD- Report 2019 wird somit eine Indikation für die zusätzliche ICS-Therapie bei Patienten mit vergleichsweise häufigen Exazerbationen und einer erhöhten Eosinophilenzahl gesehen.
Zusätzliche Erkenntnis zwischen Eosinophilen und der Rate von COPD-Exazerbationen lieferte die Phase-3-Studie ETHOS. Hier war die Verringerung der Exazerbations- rate durch LAMA/LABA/ICS gegenüber der Vergleichsmedikation generell unabhängig von der Anzahl der Eosinophilen im Blut und auch unabhängig davon, ob die Patienten in der Screeningphase ICS erhalten hatten. Allerdings nahm der Exazerbationsvorteil unter der Dreifachkombination mit zunehmender Zahl der eosinophilen Granulozyten im Blut signifikant zu vs. der Zweifachkombination von LAMA/LABA [65].
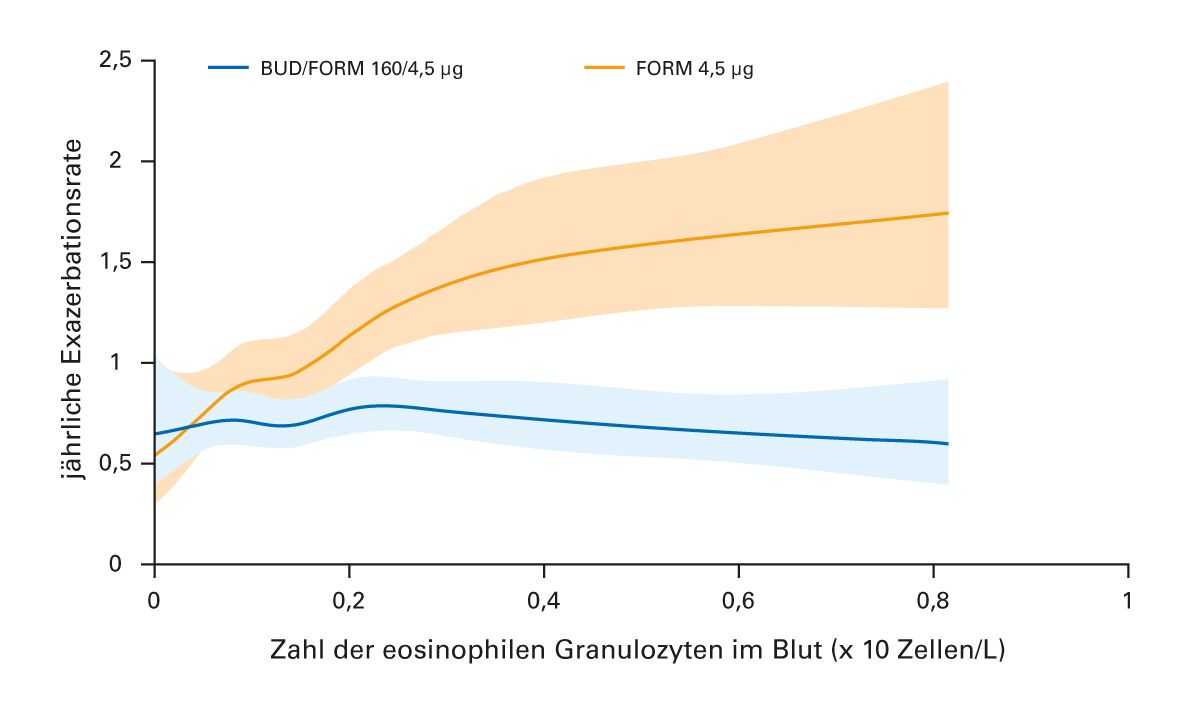
Abb. 11: Jährliche Exazerbationsrate (95 % Konfidenzintervall) für Budesonid/Formoterol 160/4,5µg (BUD/FORM) und Formoterol 4,5 µg (FORM) [60].
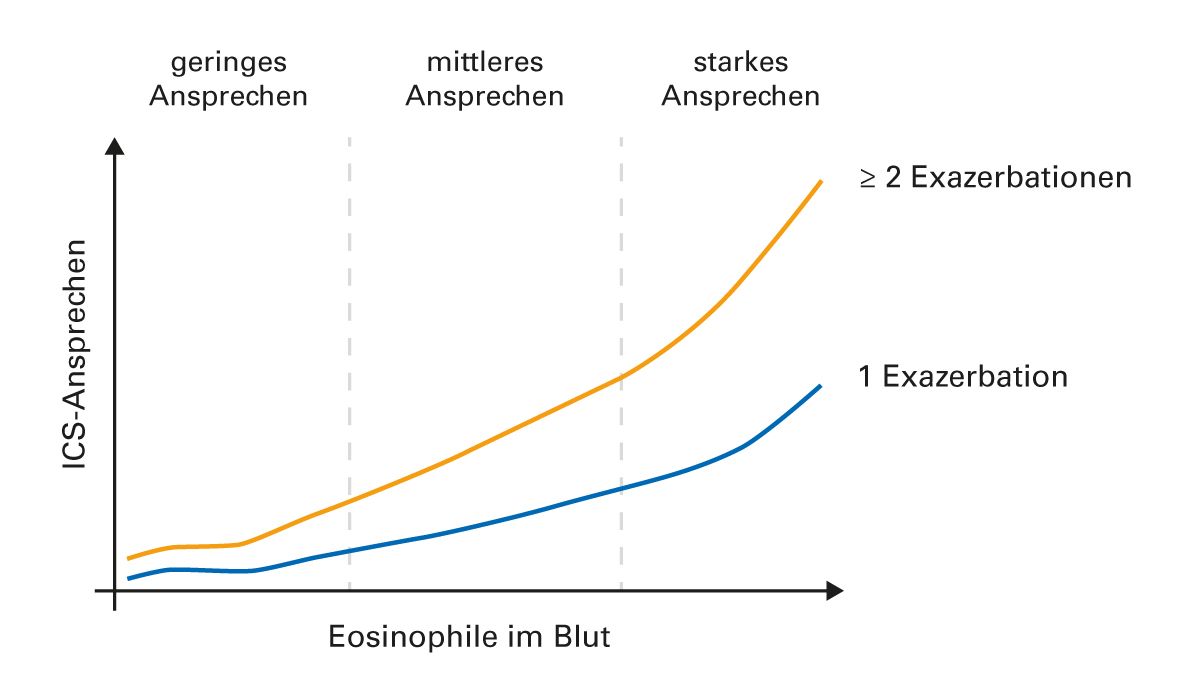
Abb. 12: Beziehung zwischen Zahl der Blut-Eosinophilen und dem ICS-Therapie-Ansprechen (Verhinderung von Exazerbationen) in Abhängigkeit von der bisherigen Exazerbationsgeschichte [61].
Die Bestimmung der Eosinophilenzahl im Blut ist in der niedergelassenen Praxis bislang noch keine Routineuntersuchung, für die Ermittlung des optimalen Therapievorgehens bei Patienten mit häufigen Exazerbationen aber von großer Bedeutung.
Das aktuelle Update GOLD 2020 schlägt ein Ampelschema zum Einsatz von ICS in Abhängigkeit von der Zahl der Blut-Eosinophilen als Biomarker vor [62] (Abb. 13).
ICS sollten bei Patienten mit bekannter chronisch bakterieller Besiedlung der Atemwege nicht bzw. zurückhaltend eingesetzt werden. Patienten mit potenziell erhöhtem Pneumonierisiko, bei denen eine eindeutige Indikation für ein ICS gegeben ist und der präventive Effekt hinsichtlich Exazerbationshäufigkeit genutzt werden soll, sollten vorsichtshalber nicht mit Fluticason, sondern einem anderen Kortikosteroid (z. B. Budesonid, Beclometason) behandelt werden [63]. Wie konkret vorzugehen ist, beschreibt der aktualisierte GOLD-Report 2019 [4] (Abb. 14).
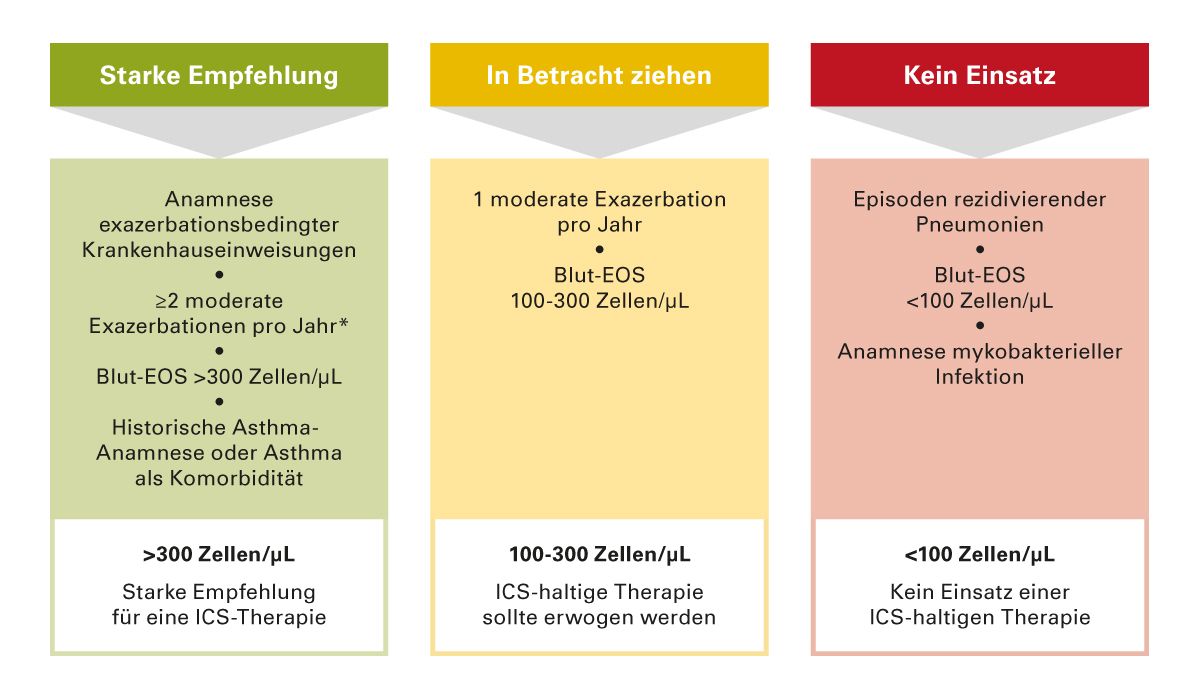
Abb. 12: Beziehung zwischen Zahl der Blut-Eosinophilen und dem ICS-Therapie-Ansprechen (Verhinderung von Exazerbationen) in Abhängigkeit von der bisherigen Exazerbationsgeschichte [61].
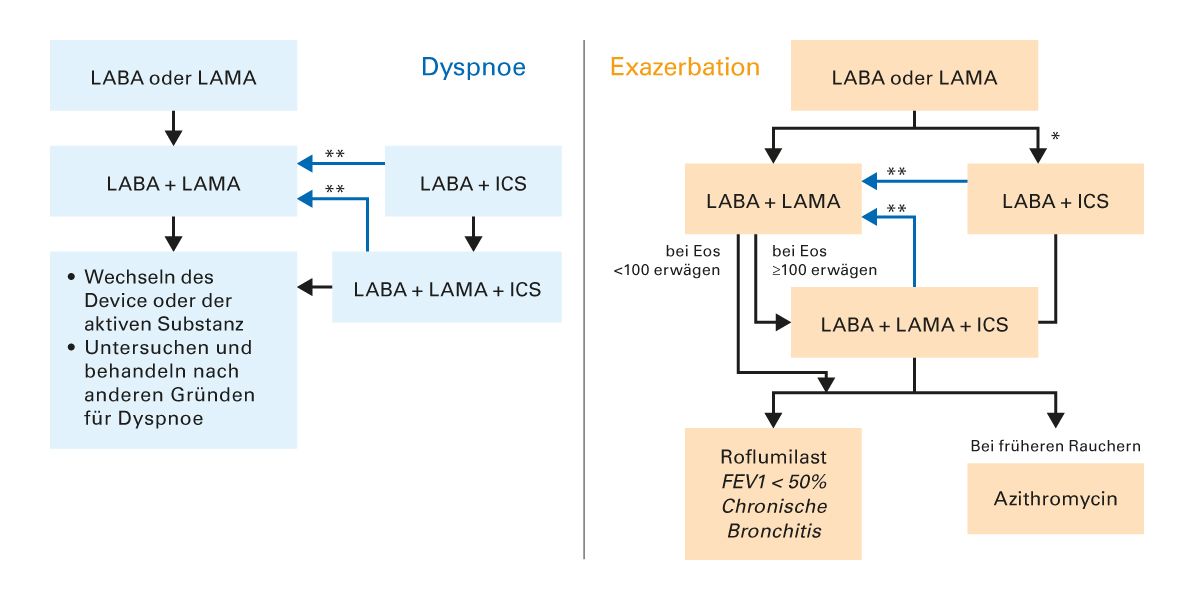
Abb. 14: Algorithmus zur Therapieeskalation und -deeskalation entsprechend der Wirksamkeit und Sicherheit der verfügbaren Therapeutika. Eos = Eosinophilenzahl im Blut (Zellen/μl); *erwägen, wenn Eos >300 oder Eos >100 UND >2 moderate Exazerbationen/1 Krankenhauseinweisung; **Deeskalation von ICS oder Umstellung erwägen bei Pneumonie, nicht geeigneter Indikation oder fehlendem Ansprechen auf ICS [4].
Adhärenz
Wie bei anderen chronischen Erkrankungen ist die Adhärenz wichtig für die Kontrolle der Erkrankung. Daher ist die Patientenschulung ein wichtiges Therapieelement für alle Schweregrade der Erkrankung. Jeder Patient mit COPD sollte Zugang zu einem strukturierten, evaluierten und zielgruppenspezifischen Schulungsprogramm (DMP COPD) erhalten und ärztlicherseits regelmäßig zur Teilnahme an den dort vorgesehenen Schulungen motiviert werden.
Dazu gehört auch eine spezielle Schulung zur Inhalationstechnik. Der Patient muss gut damit zurechtkommen, um einen optimalen Therapieerfolg zu gewährleisten. Es ist vorteilhaft, wenn Eskalation wie Deeskalation jeweils mit dem gleichen Inhalator erfolgen können. Dies erhöht die Therapieadhärenz des Patienten und reduziert den Schulungsaufwand.
Für Patienten mit leichter bis mittelschwerer COPD konnte gezeigt werden, dass mit einem ambulanten strukturierten Schulungsprogramm im Vergleich zur Kontrollgruppe die Inhalationstechnik gebessert, die Selbstkontrolle der Erkrankung gesteigert, die Zahl akuter Exazerbationen reduziert und bei Steigerung der Lebensqualität die Kosten vermindert werden [64]. Zukünftig können möglicherweise E-Health-Konzepte beim Selbstmanagement eine Rolle spielen. Aktuell liegen dazu aber noch keine ausreichend validen Daten vor.
Fazit
- Bei COPD-Patienten treten häufig akute Exazerbationen auf: mindestens 2 Tage anhaltende Verschlechterungen der respiratorischen Symptome mit der Notwendigkeit einer Therapieintensivierung.
- Exazerbationen wirken sich negativ auf die Lebensqualität der Patienten aus und können langfristig zum Rückgang der Lungenfunktion beitragen. Sie sind bei COPD- Patienten der häufigste Grund für Hospitalisierung und Mortalität.
- Das Risiko einer Exazerbation steigt mit abnehmender Lungenfunktion.
- Exazerbationen erhöhen auch das Risiko für Myokardinfarkt und Schlaganfall.
Kardiovaskuläre Komorbiditäten sollten daher proaktiv diagnostiziert werden. - Die Prävention von Exazerbationen gehört zu den zentralen Behandlungszielen der
COPD. - COPD-Patienten, die häufig exazerbieren, können von einer inhalativen Steroidtherapie profitieren. In Interventionsstudien war die Triple-Therapie (LAMA/LABA/ICS) der Zweifach-Kombinationen (LAMA/LABA) bei schwerer COPD überlegen.
- Studienbefunde legen nahe, dass die Zahl der eosinophilen Granulozyten im peripheren Blut als Biomarker für das Ansprechen auf eine zusätzliche Behandlung mit inhalativen Steroiden genutzt werden kann.
- Nicht-medikamentöse Ansätze wie Nikotinentwöhnung, Steigerung der körperlichen Aktivität und Schutzimpfungen sind wichtige Bestandteile der Therapie.
Literatur
[1] Halbert RJ, Natoli JL, Gano A et al. Global burden of COPD: systematic review and meta-analysis. Eur Respir J 2006; 28: 523–532
[2] Rycroft CE, Heyes A, Lanza L et al. Epidemiology of chronic obstructive pulmonary disease: a literature review. Int J Chron Obstruct Pulmon Dis 2012; 7: 457–494
[3] American Lung Association Epidemiology and Statistics Unit. Trends in COPD (Chronic Bronchitis and Emphysema): Morbidity and Mortality. Accessed at: http://www.lung.org/assets/documents/research/copd-trend-report.pdf 2013. (abgerufen am 13.12.2019)
[4] Global Strategy for Diagnosis, Management, and Prevention of COPD. http://goldcopd.org/ (abgerufen am 13.12.2019)
[5] Murray CJ, Atkinson C, Bhalla K et al. The state of US health, 1990-2010: burden of diseases, injuries, and risk factors.
JAMA 2013; 310: 591–608
[6] Hoogendoorn M, Feenstra TL, Boland M et al. Prediction models for exacerbations in different COPD patient populati- ons: comparing results of five large data sources. Int J Chron Obstruct Pulmon Dis 2017; 12: 3183–3194
[7] Tashkin DP, Celli B, Senn S et al. A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med 2008; 359: 1543–1554
[8] Hurst JR, Vestbo J, Anzueto A et al. Susceptibility to exacerbation in chronic obstructive pulmonary disease. N Engl J Med 2010; 363: 1128–1138
[9] Vogelmeier C, Buhl R, Burghuber O et al. Leitlinie zur Diagnose und Therapie von Patienten mit chronisch obstruktiver Bronchitis und Lungenemphysem (COPD). Pneumologie 2018; 72: 253–308
[10] Hering T, Andres J. Das Patienten-Questionnaire „Monitoring of Exacerbation Probability (MEP). Vorschlag eines Inst- rumentes zum Detektieren der Wahrscheinlichkeit von Exazerbationen für die Versorgungspraxis von COPD-Patienten.
Pneumologie 2016; 70: 98-102
[11] Agusti A, Soler JJ, Molina J et al. Is the CAT questionnaire sensitive to changes in health status in patients with severe COPD exacerbations? COPD 2012; 9: 492-498
[12] Leidy NK, Murray LT, Jones P et al. Performance of the EXAcerbations of chronic pulmonary disease tool patient- reported outcome measure in three clinical trials of chronic obstructive pulmonary disease. Ann Am Thorac Soc 2014; 11: 316–325
[13] Jones PW, Lamarca R, Chuecos F et al. Characterisation and impact of reported and unreported exacerbations: results from ATTAIN. Eur Respir J 2014; 44: 1156–1165
[14] Rodriguez-Roisin R. Toward a consensus definition for COPD exacerbations. Chest 2000; 117: 398S–401S
[15] Watz H, Tetzlaff K, Magnussen H et al. Spirometric changes during exacerbations of COPD: a post hoc analysis of the WISDOM trial. Respir Res 2018; 19: 251
[16] Donaldson GC, Seemungal TAR, Bhowmik A et al. Relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease. Thorax 2002; 57: 847–852
[17] Suissa S, DeH’Aniello S, Ernst P. Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality. Thorax 2012; 67: 957–963
[18] www.erswhitebook.org (abgerufen am 13.12.2019)
[19] Hartl S, Lopez-Campos JL, Pozo-Rodriguez F et al. Risk of death and readmission of hospital-admitted COPD exacerbations: European COPD Audit. Europ Resp J 2016; 47: 113-121
[20] Agusti A, Calverley PM, Celli B et al. Characterisation of COPD heterogeneity in the ECLIPSE cohort. Respir Res 2010; 11: 122
[21] Haughney J, Gruffydd-Jones K, Roberts J et al. The distribution of COPD in UK general practice using the new GOLD classification. Eur Respir J 2014; 43: 993–1002
[22] Magnussen H, Disse B, Rodriguez-Roisin R et al. Withdrawal of inhaled glucocorticoids and exacerbations of COPD. N Engl J Med 2014; 371: 1285–1294
[23] Barnes N, Calverley PMA, Kaplan A et al. Chronic obstructive pulmonary disease and exacerbations: patient insights from the global hidden depths of COPD survey. BMC Pulm Med 2013; 13: 54
[24] Jones PW, Lamarca R, Chuecos F et al. Characterisation and impact of reported and unreported exacerbations: results from ATTAIN. Eur Respir J. 2014; 44: 1156–1165
[25] Pavord ID, Jones PW, Burgel PR et al. Exacerbations of COPD. Int J Chron Obstruct Pulmon Dis 2016; 11: 21–30
[26] Vestbo J, Vogelmeier C, Small M et al. Inhaled corticosteroid use by exacerbations and eosinophils: a real-world COPD population. Int J Chron Obstruct Pulmon Dis. 2019; 14: 853–861
[27] Müllerová H, Shukla A, Hawkins A et al. Risk factors for acute exacerbations of COPD in a primary care population: a retrospective observational cohort study. BMJ Open 2014; 4: e006171
[28] Vestbo J. Clinical assessment, staging, and epidemiology of chronic obstructive pulmonary disease exacerbations.
Proc Am Thorac Soc 2006; 3: 252–256
[29] Xu W, Collet S, Shapiro Y et al. Negative impacts of unreported COPD ex-acerbations on health-related quality of life at 1 year. Eur Respir J 2010; 35: 1022–1030
[30] Dransfield MT, Kunisaki KM, Strand MJ et al. Acute exacerbations and lung function loss in smokers with and without chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2017; 195: 324–330
[31] Vanfleteren LE, Spruit MA, Groenen M et al. Clusters of comorbidities based on validated objective measurements and systemic inflammation in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2013; 187: 728–735
[32] Chen W, Thomas J, Sadatsafavi M et al. Risk of cardiovascular comorbidity in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Lancet Respir Med 2015; 3: 631–639
[33] Barr RG, Bluemke DA, Ahmed FS et al. Percent emphysema, airflow obstruction, and impaired left ventricular filling. N Engl J Med 2010; 362: 217–227
[34] Watz H, Waschki B, Meyer T et al. Decreasing cardiac chamber sizes and associated heart dysfunction in COPD: role of hyperinflation. Chest 2010; 138: 32–38
[35] Donaldson GC, Hurst JR, Smith CJ et al. Increased risk of myocardial infarction and stroke following exacerbation of COPD. Chest 2010; 137: 1091–1097
[36] Kunisaki KM, Dransfield MT, Anderson JA et al. Exacerbations of Chronic Obstructive Pulmonary Disease and Cardiac Events. A Post Hoc Cohort Analysis from the SUMMIT Randomized Clinical Trial. Am J Respir Crit Care Med 2018; 198: 51-57
[37] Ho TW, Tsai YJ, Ruan SY et al. In-hospital and one-year mortality and their predictors in patients hospitalized for
first-ever chronic obstructive pulmonary disease exacerbations: a nationwide population-based study. PLoS ONE 2014; 9: e114866
[38] https://www.g-ba.de/downloads/40-268-3915/DMP-A-RL_2016-07-21_Servicedokument_Anlage-11-u-12-DMP- Doku-COPD_Stand-2016-10-19.pdf (abgerufen am 13.12.2019)
[39] Triest FJ, Franssen FM, Spruit MA et al. Poor agreement between chart-based and objectively identified comorbidities of COPD. Eur Respir J 2015; 46: 1492–1495
[40] Vestbo J, Hurd SS, Agustí AG et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med 2013; 187: 347–365
[41] Dalal AA, Shah MB, D’Souza AO et al. Observational study of the outcomes and costs of initiating maintenance therapies in patients with moderate exacerbations of COPD. Respir Res 2012; 13: 41
[42] Diette GB, Dalal AA, D’Souza AO et al. Treatment patterns of chronic obstructive pulmonary disease in employed adults in the United States. Int J Chron Obstruct Pulmon Dis 2015; 10: 415–422
[43] Zhang J, Zhou JB, Lin XF et al. Prevalence of undiagnosed and undertreated chronic obstructive pulmonary disease in lung cancer population. Respirology 2013; 18: 297–302
[44] Bartels W, Adamson S, Leung L et al. Emergency department management of acute exacerbations of chronic obstructive pulmonary disease: factors predicting readmission. Int J Chron Obstruct Pulmon Dis 2018; 13: 1647–1654
[45] Anthonisen NR, Skeans MA, Wise RA et al. The effects of a smoking cessation intervention on 14.5-year mortality: a randomized clinical trial. Ann Intern Med 2005; 142: 233–239
[46] https://www.kbv.de/html/1150_32725.php (abgerufen am 13.12.2019)
[47] Eisner MD, Balmes J, Yelin EH et al. Directly measured secondhand smoke exposure and COPD health outcomes. BMC Pulm Med 2006; 6: 12
[48] Berufsgenossenschaftlicher Grundsatz für arbeitsmedizinische Vorsorgeuntersuchungen G23 – obstruktive Atemweg- serkrankungen. www.arbeitsschutzdigital.de (abgerufen am 13.12.2019)
[49] Spruit MA, Singh SJ, Garvey C et al. An official American Thoracic Society/European Respiratory Society statement: key concepts and advances in pulmonary rehabilitation. Am J Respir Crit Care Med 2013; 188: e13–64
[50] Lacasse Y, Brosseau L, Milne S et al. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2002; 3: CD003793
[51] Maltais F, Bourbeau J, Shapiro S et al. Effects of home-based pulmonary rehabilitation in patients with chronic obstructive pulmonary disease: a randomized trial. Ann Intern Med 2008; 149: 869–878
[52] Nici L, Donner C, Wouters E et al. American Thoracic Society/European Respiratory Society statement on pulmonary rehabilitation. Am J Respir Crit Care Med 2006; 173: 1390–1413
[53] Ries AL, Bauldoff GS, Carlin BW et al. Pulmonary Rehabilitation: Joint ACCP/AACVPR. Evidence-Based Clinical Practice Guidelines. Chest 2007; 131: 4S–42S
[54] Poole PJ, Chacko E, Wood-Baker RW et al. Influenza vaccine for patients with chronic obstructive pulmonary disease.
Cochrane Database Syst Rev 2000; 4: CD002733
[55] Empfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut, www.rki.de (abgerufen am 13.12.2019)
[56] Lipson DA, Barnhart F, Brealey N et al. Once-Daily Single-Inhaler Triple versus Dual Therapy in Patients with COPD. N Engl J Med 2018; 378: 1671–1680
[57] Papi A, Vestbo J, Fabbri L et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet 2018; 391: 1076–1084
[58] Ferguson GT, Rabe KF, Martinez FJ et al. Triple combination co-suspension delivery technology budesonide/glycopyr- rolate/formoterol fumarate vs. dual therapies in chronic obstructive pulmonary disease (KRONOS): a double-blind, parallel group, randomised controlled trial; Ferguson et al. Lancet Resp Med 2018; 6: 747–758
[59] Wedzicha JA Banerji D, Chapman KR et al. Indacaterol–Glycopyrronium versus Salmeterol-Fluticasone for COPD. N Engl J Med 2016; 374: 2222–2234
[60] Bafadhel M, Peterson S, de Blas MA et al. Predictors of exacerbation risk and response to budesonide in patients with chronic obstructive pulmonary disease: a post-hoc analysis of three randomised trials. Lancet Respir Med 2018; 6: 117–126
[61] Singh D. Predicting Corticosteroid Response in Chronic Obstructive Pulmonary Disease. Blood Eosinophils Gain Momentum. Amer J Resp Crit Care Med 2017; 196: doi: 10.1164/rccm.201703-0592ED
[62] Agusti A, Fabbri LM, Singh D et al. Inhaled corticosteroids in COPD: friend or foe? Europ Resp J 2018; 52: 1801219
[63] Schreiber J, Vogelmeier C. Symbicort. Aktueller Stellenwert der inhalativen Kortikosteroide bei der COPD. Praxis Report 2019, 11 (7): 1-12
[64] Worth H, Dhein Y. Does patient education modify behaviour in the management of COPD? Patient Educ Couns 2004; 52: 267–270
[65] N Engl J Med 2020; 383:35-48 DOI: 10.1056/NEJMoa1916046
[66] Lipson et al., Am J Respir Crit Care Med. 2020 Jun 15;201(12):1508-1516. doi: 10.1164/rccm.201911-2207OC. Reduction in All-Cause Mortality with Fluticasone Furoate/Umeclidinium/Vilanterol in Patients with Chronic Obstructive Pulmonary Disease;
[67] Fabbri et al., Reduction in fatal events with extrafine inhaled corticosteroid (ICS)-containing medications: results of stratified safety pooled analysis of the TRILOGY, TRINITY and TRIBUTE studies, European Respiratory Journal 2018 52: OA1659; DOI: 10.1183/13993003.congress-2018.OA1659;
[68] Rabe et al., Triple Inhaled Therapy at Two Glucocorticoid Doses in Moderate-to-Very-Severe COPD, N Engl J Med. 2020 Jul 2;383(1):35-48. doi: 10.1056/NEJMoa1916046;
[69] Global strategy for diagnosis, management, and prevention of chronic obstructive pulmonary disease 2021 Report. https://goldcopd.org/wp-content/uploads/2020/11/GOLD-REPORT-2021-v1.0-16Nov20_WMV.pdf
Bildquellen
Titel: © motortion – stock.adobe.com


Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der arztCME-Online-Akademie erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.