Biosimilars in der Dermatologie
Dieses Fortbildungsmodul liegt der Ärztekammer zur Zertifizierung vor.
Interessengebiete: Allgemeinmedizin und Innere Medizin, Haut- und Geschlechtskrankheiten, Biosimilars, Immunologie
Die Einführung der TNF-Inhibitoren vor über 20 Jahren hat die Psoriasis-Therapie revolutioniert und die Qualität der Versorgung von Patienten mit chronisch-entzündlichen Hautkrankheiten in Deutschland maßgeblich verbessert, aber auch die Gesundheitskosten erhöht. Ein weiterer Meilenstein war die Entwicklung und Zulassung von Biosimilars, die durch Kostensenkungen dazu beitrugen, den Zugang zur leitliniengerechten Therapie mit innovativen Wirkstoffen zu verbessern. Inzwischen haben sich Biosimilars im klinischen Alltag bewährt, wie Real-World-Studien und europäische Register zeigen. Dennoch besteht weiterhin Optimierungsbedarf: Die Verordnungsquote von Biosimilars ist gering und entgegen der Leitlinien-Empfehlungen machen Glukokortikosteroide zu häufig den Hauptanteil der systemischen Therapien aus.
In dieser Fortbildung erhalten Sie Informationen über die Leitlinienempfehlungen insbesondere im Hinblick auf TNF-Inhibitoren sowie einen Überblick zur Entwicklung und Anwendung von Biosimilars in der klinischen Praxis. Zusätzlich wird auch die Frage diskutiert, ob eine Therapie mit Biologika das Risiko für schwere COVID-19-Verläufe erhöhen kann.
Wenn Sie das Video zur arztCME-Fortbildung herunterladen wollen, registrieren Sie sich bitte oder melden Sie sich an.
Kursinhalt
Inhaltsverzeichnis
- Einleitung
- Epidemiologie der Psoriasis vulgaris, Psoriasis- Arthritis und Acne Inversa
- Klassifikation, Therapieziele und Therapie-Empfehlungen
- TNF-Inhibitoren bei dermatologisch entzündlichen Krankheiten
- Entwicklung und Stellenwert der TNF-Inhibitor-Biosimilars
- Real-World-Daten: Psoriasis-Therapie mit TNF-Inhibitor-Biosimilars
- Biologika-Therapie und COVID-19
- Fazit
- Abkürzungen
- Quellen
Einleitung
Die Einführung der TNF-Inhibitoren vor über 20 Jahren hat die Psoriasis-Therapie revolutioniert und die Qualität der Versorgung von Patienten mit chronisch-entzündlichen Hautkrankheiten in Deutschland maßgeblich verbessert, aber auch die Gesundheitskosten erhöht. Ein weiterer Meilenstein war die Entwicklung und Zulassung von Biosimilars, die durch Kostensenkungen dazu beitrugen, den Zugang zur leitliniengerechten Therapie mit innovativen Wirkstoffen zu verbessern. Inzwischen haben sich Biosimilars im klinischen Alltag bewährt, wie Real-World-Studien und europäische Register zeigen. Dennoch besteht weiterhin Optimierungsbedarf: Die Verordnungsquote von Biosimilars ist gering und entgegen der Leitlinien-Empfehlungen machen Glukokortikosteroide zu häufig den Hauptanteil der systemischen Therapien aus.
In dieser Fortbildung erhalten Sie Informationen über die Leitlinienempfehlungen insbesondere im Hinblick auf TNF-Inhibitoren sowie einen Überblick zur Entwicklung und Anwendung von Biosimilars in der klinischen Praxis. Zusätzlich wird auch die Frage diskutiert, ob eine Therapie mit Biologika das Risiko für schwere COVID-19-Verläufe erhöhen kann.
Epidemiologie der Psoriasis vulgaris, Psoriasis- Arthritis und Acne Inversa
Psoriasis vulgaris (PsO) ist eine chronische Immunerkrankung, die sich primär auf der Haut manifestiert und in jedem Lebensalter auftreten kann. Die Ein-Jahresprävalenz in Deutschland wird auf ca. 2,5 % geschätzt, wobei Frauen und Männer etwa zu gleichen Anteilen betroffen sind. Die höchsten Prävalenzraten mit 4,0-4,2 % wurden in den Altersgruppen zwischen 50-79 Jahren ermittelt [1]. Es wird geschätzt, dass etwa 20 % der Psoriasis-Patienten unter einer mittel- bis schwer ausgeprägten Form leiden – dies entspricht etwa 400.000 Patienten in Deutschland [2].
Nach einer durchschnittlichen Dauer von etwa 10 Jahren entwickeln etwa 20-30 % der Psoriasis-Patienten eine Psoriasis-Arthritis (PsA), die vor allem Gelenke betrifft und unbehandelt zu irreparablen Gelenkschäden führen kann [3]. Die altersspezifische Inzidenz der PsA zeigt einen kontinuierlichen Anstieg mit zunehmendem Alter bis sie kurz vor dem 60. Lebensjahr ihren Höhepunkt mit 0,3-0,4 % erreicht [4]. Neben Haut- und Gelenkmanifestation können die entzündlichen Veränderungen auch Enthesen, Bänder und Gelenkkapseln betreffen; ebenso den Knochen und periostale Strukturen [5]. Die Erkrankung ist insgesamt komplex und kann einen sehr heterogenen Verlauf nehmen [6].
Die Acne inversa (AI), auch Hidradenitis suppurativa (HS) genannt, wird als chronisch rezidivierende Hauterkrankung des terminalen Haartalgdrüsenapparats definiert, die sich mit schmerzhaften, entzündlichen Läsionen in den an apokrinen Drüsen reichen Körperregionen manifestiert [7]. Unter den dermatologischen Krankheitsbildern zählt die AI zu den Erkrankungen mit der ausgeprägtesten Minderung der Lebensqualität [8]. Eine Analyse von 20.112 Personen der deutschen erwerbstätigen Bevölkerung zeigte eine Punktprävalenz anhand der typischen AI-Läsionen von 0,3 % [7].
Klassifikation, Therapieziele und Therapie-Empfehlungen
Psoriasis vulgaris (PsO)
Der Psoriasis-Schweregrad wird laut den aktuellen S3-Leitlinien anhand der befallenen Körperoberfläche (BSA), des Schweregradindex (PASI) und des Dermatologischen Lebensqualitätsindex (DLQI) klassifiziert [9]. Die aktuelle praxisrelevante Einteilung des Psoriasis-Schweregrades basiert auf einem Europäischen Konsensusprojekt aus dem Jahr 2011 [10] und wird auch als „Rule of Ten“ bezeichnet (Abb. 1). Demzufolge ist bei einem BSA oder PASI und DLQI ≤ 10 % bzw. ≤ 10 Punkten die Diagnose einer leichten Psoriasis zu stellen und bei einem BSA oder PASI und DLQI > 10 % bzw. Punkten die Diagnose einer mittel bis schweren Psoriasis. Dabei wird eine leichte Psoriasis beim Vorliegen der sogenannten Upgrade-Kriterien in eine mittelschwere bis schwere Form eingeordnet (Abb. 1) [9]. Der Schweregrad kann nach einem Vorschlag der Onkoderm- Autorengruppe aus dem Jahr 2016 weiter differenziert werden, so dass es sich bei einem BSA, PASI und DLQI ≥ 20 um eine sehr schwere Ausprägung handelt, die einen Firstline-Einsatz von Biologika zulässt [11].
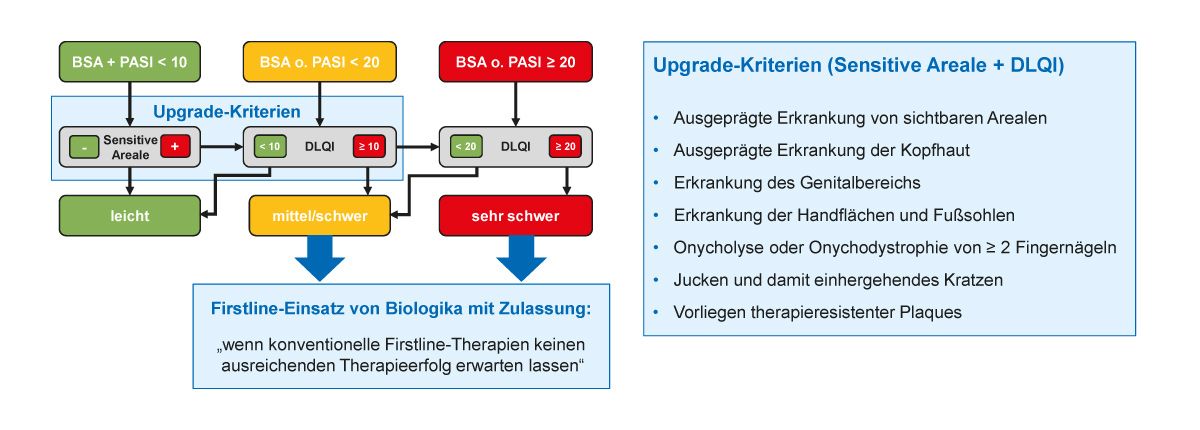
Abb. 1: Klassifikation und Therapie-Empfehlungen der Psoriasis laut S3-Leitlinien [9] und praxisna- hem Behandlungspfad [11] (Grafik modifiziert nach [11])
Gemäß der S3-Leitlinie ist ab einer mittelschweren bis schweren Psoriasis eine Fototherapie oder systemische Therapie indiziert, wobei Biologika als Firstline-Therapie eingesetzt werden können, wenn konventionelle Therapien keinen ausreichenden Therapieerfolg erwarten lassen [9].
Das grundsätzliche Ziel jeder Psoriasis-Therapie ist die Erscheinungsfreiheit, das heißt die Abwesenheit von kutanen Symptomen der Psoriasis. Da dieses Ziel jedoch realistischerweise nicht bei allen Patienten erreicht werden kann, sollte ein Mindestziel definiert werden, dass zu einem festgelegten Zeitpunkt bei einer Behandlung erreicht werden muss. Das minimale Therapieziel laut S3-Leitlinien ist eine PASI-75-Antwort. Derzeit wird aber auch über höhere Therapieziele oder über einen absoluten PASI < 3 diskutiert [9]. So empfiehlt die Onkoderm-Autorengruppe einen absoluten PASI-Wert < 3 als Therapieziel, da eine 75 %ige Verbesserung bei einer sehr schweren Psoriasis als unzureichend angesehen wird [11].
Die Therapieziele sollten im Behandlungsverlauf regelmäßig kontrolliert werden. Das Ansprechen auf die Therapie wird am Ende der Induktionsphase je nach indivi- dueller Wirkstoff-Charakteristik evaluiert. Während der Erhaltungstherapie findet das Therapiemonitoring in der Regel einmal im Quartal statt. Die Anpassung der Therapie kann beispielsweise durch Dosissteigerung, Einleitung einer Kombinationstherapie oder durch Umstellung auf ein anderes Medikament erreicht werden [9, 11].
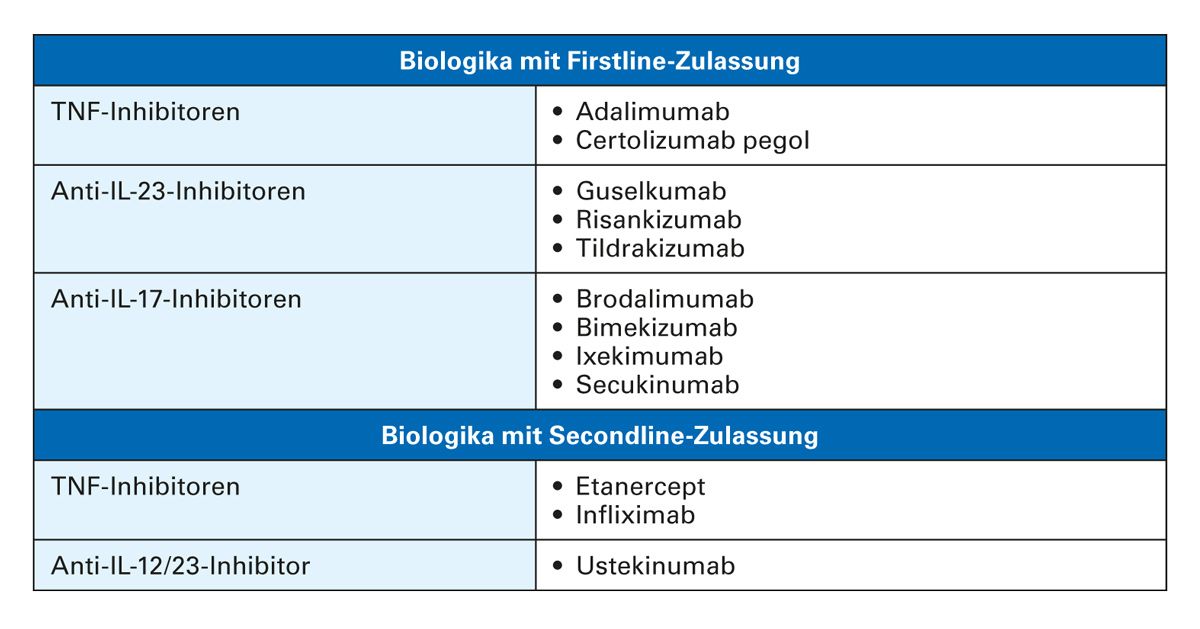
Tab. 1: Biologika mit Firstline- und Secondline-Zulassung zur Behandlung der mittelschweren bis schweren Psoriasis vulgaris laut Fachinformation [12]
Im Bereich der systemischen Therapien hat sich das Spektrum moderner Psoriasis-Therapeutika durch die Zulassung neuer Biologika in den letzten Jahren permanent erweitert. Die Einleitung einer Biologika-Therapie wird generell empfohlen, wenn die konventionelle Therapie keinen ausreichenden Therapieerfolg gezeigt hat oder unverträglich oder kontraindiziert ist. In diesem Fall wird die Einleitung einer Therapie mit einem Biologikum mit einem “Firstline-label” laut Zulassung empfohlen (Tab. 1) [9]. Kein ausreichender Therapieerfolg ist zu erwarten z. B. bei besonders schwerer Ausprägung (PASI ≥ 20), rascher Verschlechterung, schwerer Beteiligung der Nägel, des Genitalbereichs oder der Kopfhaut oder besonders hoher Beeinträchtigung der Lebensqualität (z. B. DLQI ≥ 15) [9]. Aber auch für eine mittelschwere Psoriasis kommt der Firstline-Einsatz von Biologika in Betracht. Entscheidende Kriterien für die Wirkstoff-Auswahl sind [11]:
• Krankheitsschwere
• Komorbidität
• Kontraindikationen
• Individuelle patientendefinierte Bedürfnisse
Neben den beiden TNF-Inhibitoren, Adalimumab und Certolizumab pegol, stehen inzwischen mehrere Anti-IL-23- und Anti-IL-17-Inhibitoren als Firstline-Biologika zur Verfügung, die laut Studiendaten ein stärkeres PASI-Ansprechen im Vergleich zu TNF- Inhibitoren aufweisen [13]. Allerdings gibt es bisher keine Leitlinienempfehlungen zur Reihenfolge der Anwendung von Biologika mit Firstline-Zulassung bei Psoriasis vulgaris und auch direkte Head-to-Head-Studien zum Vergleich der Wirksamkeit fehlen [9].
Psoriasis-Arthritis (PsA)
Bisher sind zur Diagnostik und Therapie der PsA keine deutschen Leitlinien verfügbar, daher basiert die Klassifikation des PsA-Schweregrads auf den internationalen GRAPPA- Empfehlungen (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis), die 2016 publiziert [14] und zuletzt 2021 im Rahmen des EULAR-Kongresses aktualisiert wurden [15]. Die GRAPPA-Empfehlungen schlagen die Einteilung der Krankheitsstadien in leicht, mittelschwer und schwer vor. Diese Einteilung bezieht sich auf den Schweregrad der einzelnen Symptome und nicht auf die Erkrankung im Gesamtkontext. Die Wahl der Therapie sollte idealerweise alle Domänen (Arthritis, Enthesitis, Daktylitis, axialer Befall und Haut- bzw. Nagelbefall) berücksichtigen und in einem gemeinsamen Entscheidungsprozess zusammen mit dem Patienten getroffen werden. Zusätzlich sollten auch Komorbiditäten, wie Uveitis oder chronisch-entzündliche Darmerkrankung (CED), bei der Auswahl der Therapie berücksichtigt werden [15]. Unter den Firstline-Therapeutika stellen TNF-Inhibitoren und IL-17-Inhibitoren die einzigen Optionen dar, die in allen sechs Domänen empfohlen werden, also wenn eine aktive Enthesitis, eine Beteiligung der Nägel oder eine Daktylitis vorliegt sowie bei einer axialen Beteiligung und unzureichendem Ansprechen auf nichtsteroidale Antirheumatika (NSAR) (Abb. 2) [15].
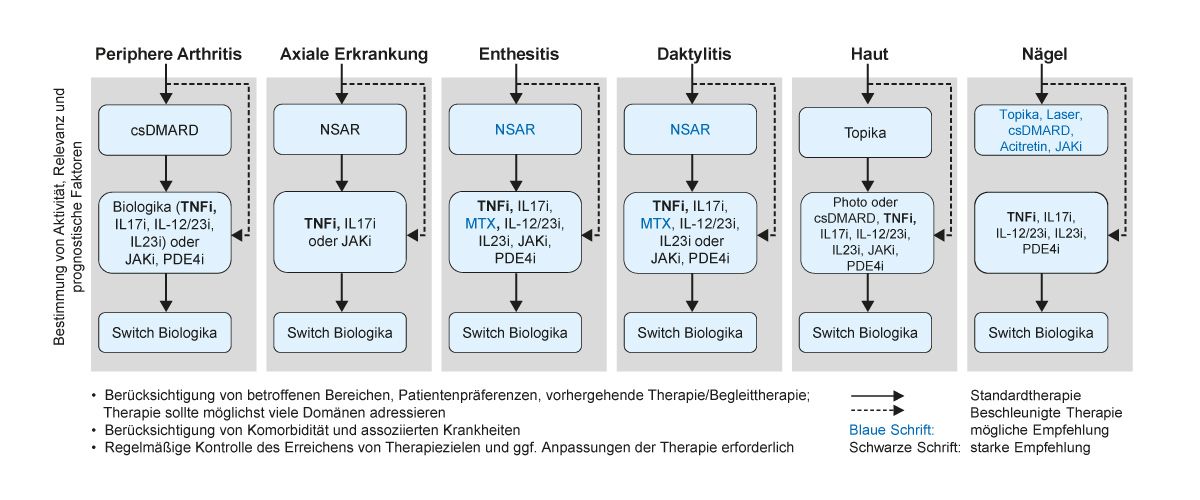
Abb. 2: Therapie-Empfehlungen laut GRAPPA 2021 (Abbildung modifiziert nach [15])
csDMARD: konventionelle krankheitsmodifizierende Antirheumatika; IL: Interleukine; JAKi: Januskinase-Inhibitor; MTX: Methotrexat; NSAR: nichtsteroidale Antirheumatika; PDE4i: Phosphodiesterase-4-Inhibitor;
TNFi: Tumornekrosefaktor-Inhibitor
Acne inversa (AI)
Für die Klassifikation des Schweregrads der AI wird meist die statische Einteilung in die Stadien I-III nach Hurley genutzt, die auf der Verbreitung der Abszesse und Fisteln basiert (Tab. 2). Eine weitere Klassifikation bietet der Sartorius-Score anhand einer dynamischen Beurteilung der Schwere der Krankheit [16]. Da die AI mit einer besonders starken Minderung der Lebensqualität einhergeht, werden als Therapieziele laut Leitlinien die Verbesserung um einen Schweregrad der Hurley-Klassifikation oder die Verbesserung des DLQI um 25 % innerhalb von 12 Wochen definiert. Therapiemodifikation sollten erfolgen, wenn nach 12 Wochen keine Reduktion der entzündlichen Aktivität der Läsionen oder keine Besserung der Lebensqualität eingetreten ist [17].
Die systemische Therapie wird bei AI eingeleitet bei Nichtansprechen der Lokaltherapie oder physikalischer Therapie, insbesondere bei starker entzündlicher Aktivität. Hierbei kommen je nach Aktivität und Leidensdruck meist zunächst Antibiotika zum Einsatz. Alternativ kann auf eine zeitlich begrenzte hochdosierte Zinkgabe und auf eine Hormontherapie bei Frauen ausgewichen werden. Die einzige explizit für AI zugelassene systemische Therapie ist der TNF-Inhibitor Adalimumab [12, 17].
TNF-Inhibitoren bei dermatologisch entzündlichen Krankheiten
Der Tumornekrosefaktor (TNF) wurde erstmals 1975 als Mediator für die Endotoxin- induzierte Tumornekrose beschrieben [18] und gehört zu den Zytokinen. Er wird hauptsächlich von Makrophagen ausgeschüttet und ist als proinflammatorischer multifunktionaler Signalstoff des Immunsystems grundlegend an vielen Prozessen von Entzündungsreaktionen und Abwehr intrazellulärer Krankheitserreger beteiligt. Infolge der durch TNF ausgelösten Entzündungsprozesse kann es zu immunvermittelten entzündlichen Erkrankungen kommen. Mit dem Verständnis der jeweiligen krankheitsspezifischen Immunpathogenese hat sich die Blockade des zentralen Entzündungsfaktors TNF durch TNF-Inhibitoren als effektive Therapie dieser entzündlichen Systemerkrankungen etabliert [19]. Bei der Pathophysiologie der Psoriasis spielt die überschießende Produktion der proinflammatorischen Zytokine, TNF und Interleukine (IL) 12, 17 und 23 eine zentrale Rolle [20, 21].
Die Therapie mit TNF-Inhibitoren greift relativ früh in den entzündlichen Prozess ein und unterbindet die Sekretion der proinflammatorischen Zytokine durch Keratinozyten. Die Wirksamkeit und Sicherheit der TNF-Inhibitoren zur Behandlung der Psoriasis hat sich inzwischen seit 18 Jahren bewährt [22]. TNF-Inhibitoren haben sich zur Behandlung der mittelschweren bis schweren Psoriasis als wirksam erwiesen. Sie reduzieren die epidermale Entzündung sowie die gesteigerte proliferative Aktivität und die gestörte Ausreifung der Keratinozyten mit der charakteristischen verstärkten Verhornung [19]. Die Therapien mit den TNF‐Inhibitoren zeigten erstmals PASI 75‐Antworten bei 50-90 % der Patienten mit Psoriasis [23].
Als erster TNF-Inhibitor kam Infliximab im Jahr 1999 auf den Markt, zunächst zur Behandlung der Rheumatoiden Arthritis (RA) und seit 2004 auch zur Behandlung der Psoriasis-Arthritis (PsA). Es handelt sich um einen chimären, humanmurinen, monoklo- nalen IgG1-Antikörper. Im Jahr 2000 folgte die Zulassung des humanen Fusionsproteins Etanercept, zunächst für RA und seit 2004 auch zur Behandlung der PsA. Die monoklonalen, humanen IgG-Antikörper Adalimumab und Golimumab erhielten die Zulassung zur Behandlung der PsA im Jahr 2005 bzw. 2009. Im Jahr 2013 wurde Certolizumab pegol zunächst zur Behandlung der PsA zugelassen und erhielt 2018 die Zulassungserweiterung zur Behandlung der Plaque-Psoriasis. Es handelt hierbei sich um ein rekombinantes humanisiertes Antikörper-Fab-Fragment [12].
Tabelle 3 gibt eine Übersicht über den aktuellen Zulassungsstatus in Deutschland der TNF-Inhibitoren bei PsO, PsA und AI laut Fachinformation [12] und S3-Leitlinie Psoriasis [9]. Für die Behandlung der mittelschweren bis schweren Psoriasis werden TNF- Inhibitoren entweder als Erstlinien- oder als Zweitlinien-Biologika von der S3-Leitlinie empfohlen [9]. Für die Therapie der mittelschweren bis schweren Psoriasis sind Adalimumab und Certolizumab als Erstlinientherapie sowie Infliximab und Etanercept als Zweitlinientherapie zugelassen. Adalimumab hat eine Zulassung als Erstlinientherapie für die Behandlung von Kindern und Jugendlichen ab 4 Jahren mit schwerer chronischer Plaque-Psoriasis, die nur unzureichend auf eine topische Therapie und Fototherapien angesprochen haben oder für die diese Therapien nicht geeignet sind [12].
Bei der Therapie der Psoriasis-Arthritis können alle fünf TNF-Inhibitoren mit oder ohne gleichzeitige Gabe von Methotrexat angewendet werden, wenn das Ansprechen auf konventionelle krankheitsmodifizierende Medikamente unzureichend ist und eine hohe Krankheitsaktivität oder ungünstige Prognosefaktoren vorliegen [12, 15].
Adalimumab ist als einziger TNF-Inhibitor für die Therapie der mittelschweren bis schweren aktiven AI bei Erwachsenen und Jugendlichen ab einem Alter von 12 Jahren zugelassen [12].

Tab. 3: Zulassungsstatus der TNF-Inhibitoren in Deutschland bei Psoriasis, Psoriasis-Arthritis und Acne inversa [9, 12]
Entwicklung und Stellenwert der TNF-Inhibitor-Biosimilars
Nach Ablauf des Patentschutzes von biologischen Arzneimitteln, in der Regel nach 10-15 Jahren, ist der Markt offen für Biosimilars. Die Einführung der Biosimilars ermöglichte deutliche Kosteneinsparungen im Gesundheitssystem und somit eine bessere Versorgung der Patienten. Die ersten Biosimilars zu TNF-Inhibitoren wurden im Jahr 2013 zu Infliximab zugelassen, gefolgt von den Biosimilars zu Etanercept im Jahr 2016 und zu Adalimumab im Jahr 2017 (Abb. 3). Zu Certolizumab pegol und Golimumab gibt es bislang noch keine Biosimilars.
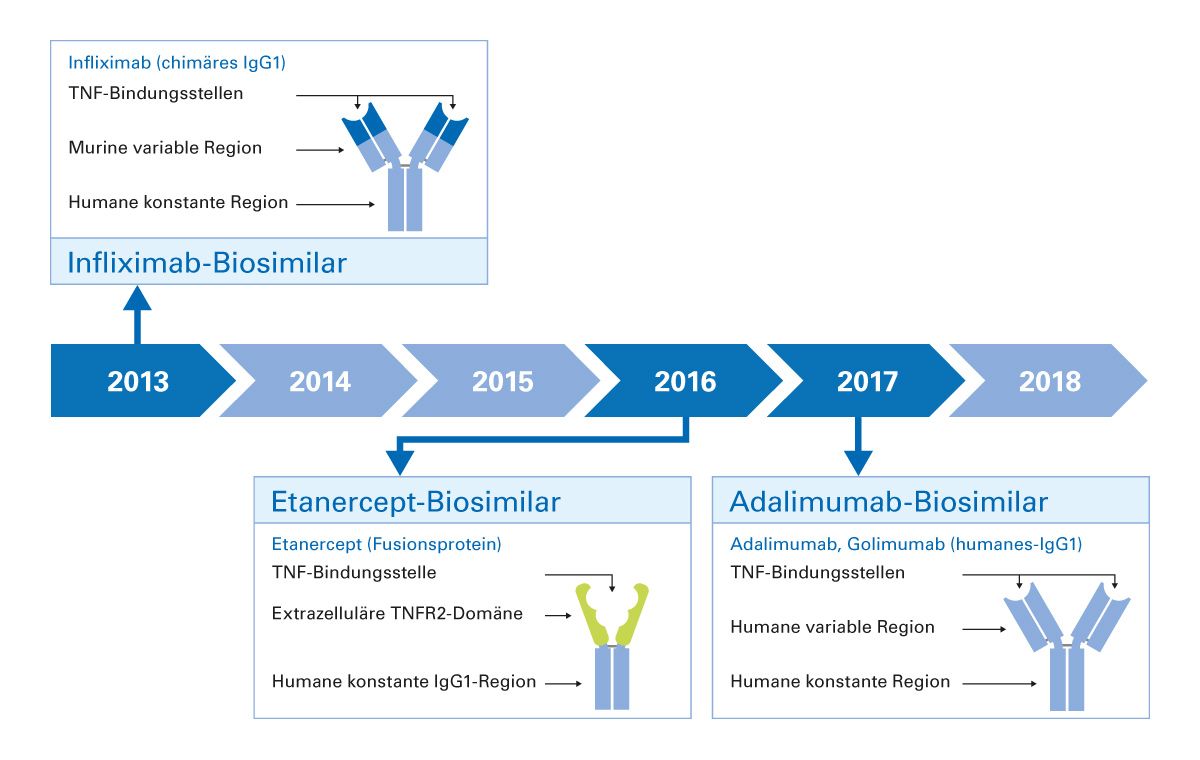
Abb. 3: Biosimilars zu Infliximab, Etanercept und Adalimumab kamen jeweils 2013, 2016 und 2017 auf den Markt.
Um die Biosimilarität zum Referenzprodukt zu gewährleisten, durchlaufen Biosimilars im Entwicklungsprozess ein aufwändiges schrittweises Prüfverfahren [24]. Bei der Zulassung von Biosimilars muss die Wirksamkeit des biosimilaren Wirkstoffs nicht neu belegt werden, da dies bereits beim Referenzarzneimittel erfolgt ist. Stattdessen muss der Nachweis der vergleichbaren klinischen Wirksamkeit erbracht werden. Anstelle klinischer Studien zu Wirksamkeit und Sicherheitsprofil steht die Analytik und exakte biochemische Charakterisierung als Basis für den Nachweis der Biosimilarität im Vordergrund. Studien zur pharmazeutischen Qualität sind für Biosimilars wesentlich aufwändiger. Durch vergleichende klinische Phase-I- und Phase-III-Studien werden Sicherheitsprofil und Wirksamkeit des Biosimilars im Vergleich zum Referenzarzneimittel untersucht und die Biosimilarität bestätigt. Phase-III-Studien werden in einer ausreichend sensitiven Indikation durchgeführt und über das Prinzip der Extrapolation erfolgt die Zulassung anschließend auch für die übrigen Indikationen des Referenzbiologikums [25].
Die klinischen Erfahrungen der letzten 15 Jahre haben inzwischen übereinstimmend gezeigt, dass Biosimilars genauso wirksam und verträglich sind wie Original-Biologika [26]. Die Einführung der Biosimilars in den europäischen Markt führte zu einer Wettbewerbssituation, wodurch es zu deutlichen Preissenkungen kam, sowohl der Biosimilars selbst, aber auch der Referenzarzneimittel. Insgesamt trug die Einführung der Biosimilars wesentlich zur Kostenentlastung des Gesundheitssystems bei. Die eingesparten Ressourcen können zur Verbesserung der Versorgung eingesetzt werden, so dass allen Patienten der Zugang zu einer leitliniengerechten Therapie ermöglicht wird [26, 27].
Aktuelle Studiendaten zeigen jedoch, dass es immer noch Verbesserungspotenzial bei der Versorgung von Psoriasis-Patienten gibt. In einer Untersuchung von Kranken- kassendaten für das Jahr 2019 wurde festgestellt, dass entgegen den Leitlinien als häufigste systemische Therapie Glukokortikosteroide mit fast 12 % verordnet wurden. Dagegen erhielten nur etwa 5 % der Psoriasis-Patienten eine leitlinienkonforme Therapie mit Biologika, davon etwa zur Hälfte mit TNF-Inhibitoren. Als Biologikum wurde am häufigsten der TNF-Inhibitor Adalimumab eingesetzt [28].
Im aktuellen Psoriasisreport wurden Daten der Techniker Krankenkasse von 2017 bis 2019 analysiert. Demzufolge betrug der Anteil an Biologika im Jahr 2019 insgesamt 13,4 % am Gesamtverordnungsvolumen, davon entfielen 10,6 % auf Original-Biologika und 2,8 % auf Biosimilars [2] (Abb. 4). Obwohl der Anteil an Biosimilars seit 2017 von 0,7 % auf 2,8 % angestiegen ist, entfielen im Jahr 2019 etwa 80 % der Biologika-Verordnungen auf Original-Biologika und nur etwa 20 % auf Biosimilars. Bei der Betrachtung der Einzel-Wirkstoffe machten die TNF-Inhibitoren, Adalimumab, Etanercept und Infliximab knapp die Hälfte aller Biologika-Verordnungen aus, wobei der Hauptanteil mit 24 % auf Adalimumab entfiel [2] (Daten nicht als Abbildung gezeigt).
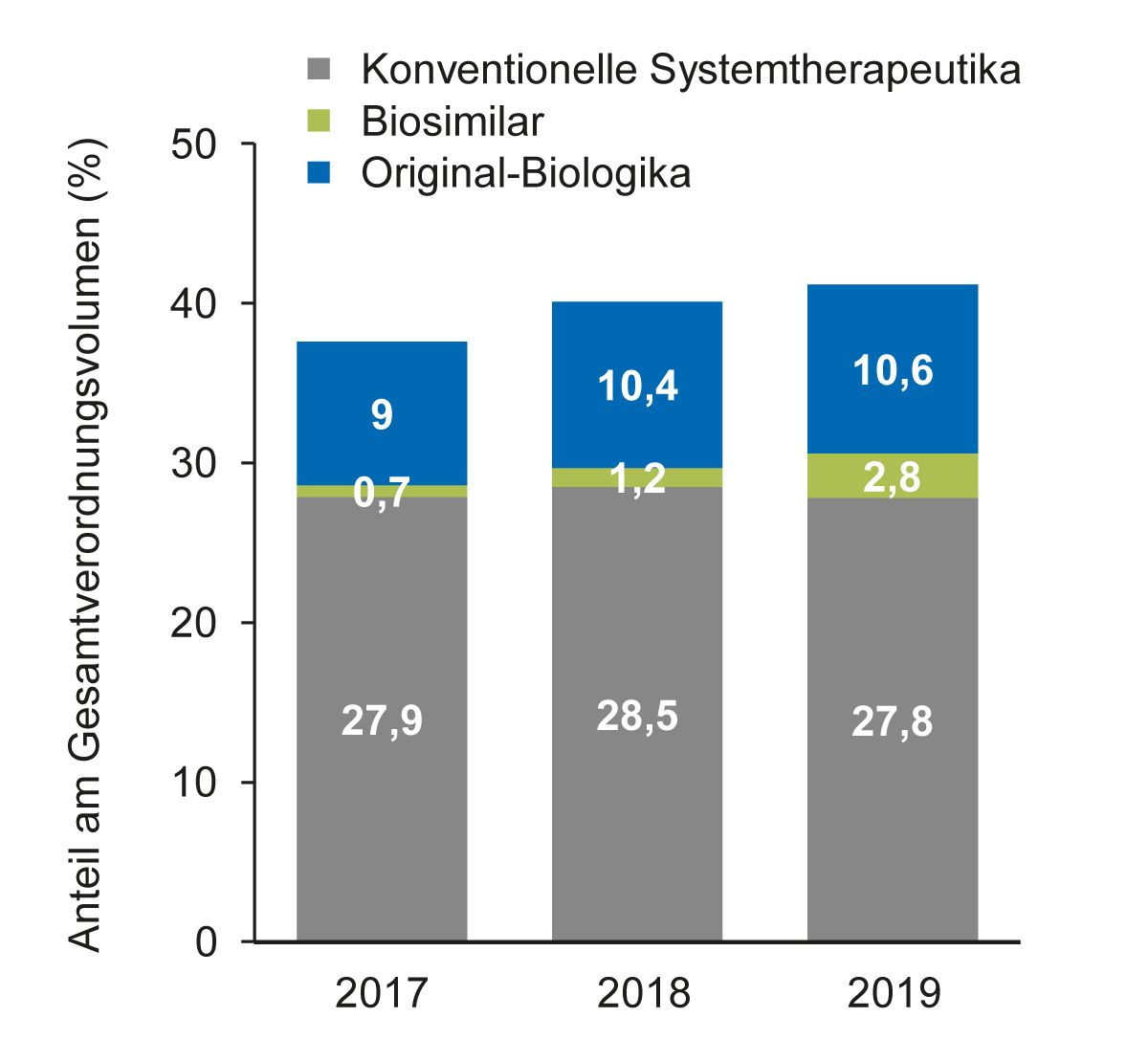
Abb. 4: Anteil von konventionellen Systemtherapeutika, Original-Biologika und Biosimilars am Gesamtverordnungsvolumen für Psoriasis in Deutschland von 2017-2019 laut Psoriasisreport [2]
Obwohl bisher nicht zu allen Biologika Biosimilars zur Verfügung stehen, wie u. a. zu Anti-IL17- und Anti-IL23-Inhibitoren, wäre dennoch auf Basis der aktuellen Verordnungszahlen theoretisch eine Verdopplung des Biosimilar-Verordnungsanteils (auf 40 %) möglich, wenn die Original-Biologika der drei TNF-Inhibitoren Adalimumab, Etanercept und Infliximab vollständig durch Biosimilars ersetzt werden würden [2].
Real-World-Daten: Psoriasis-Therapie mit TNF-Inhibitor-Biosimilars
Biosimilars haben sich inzwischen in der klinischen Praxis zur Behandlung von dermatologisch entzündlichen Krankheiten bewährt. Dies zeigt die zunehmende Anzahl von Real- World-Daten. Mehrere europäische Psoriasis-Register wurden in den letzten 10 Jahren eingerichtet, um die langfristige Wirksamkeit und das Sicherheitsprofil von Biosimilars bei Patienten mit Psoriasis in der klinischen Praxis zu untersuchen. Dazu gehört das Psobiosimilar-Register in Italien [29, 30] und das BADBIR-Register in UK und Irland [31]. In das Psobiosimilar-Register wurden von 2016 bis 2018 fast 800 Patienten eingeschlossen, darunter 197 Patienten, die mit dem Etanercept-Biosimilar SB4 behandelt wurden [30]. Bei 158 Patienten mit einem Switch vom Original-Etanercept auf SB4 blieben die PASI-Werte unverändert stabil, während sich bei 39 Etanercept-naiven Patienten, die das Biosimilar SB4 erhielten, die PASI-Werte signifikant verbesserten (Abb. 5) [30].
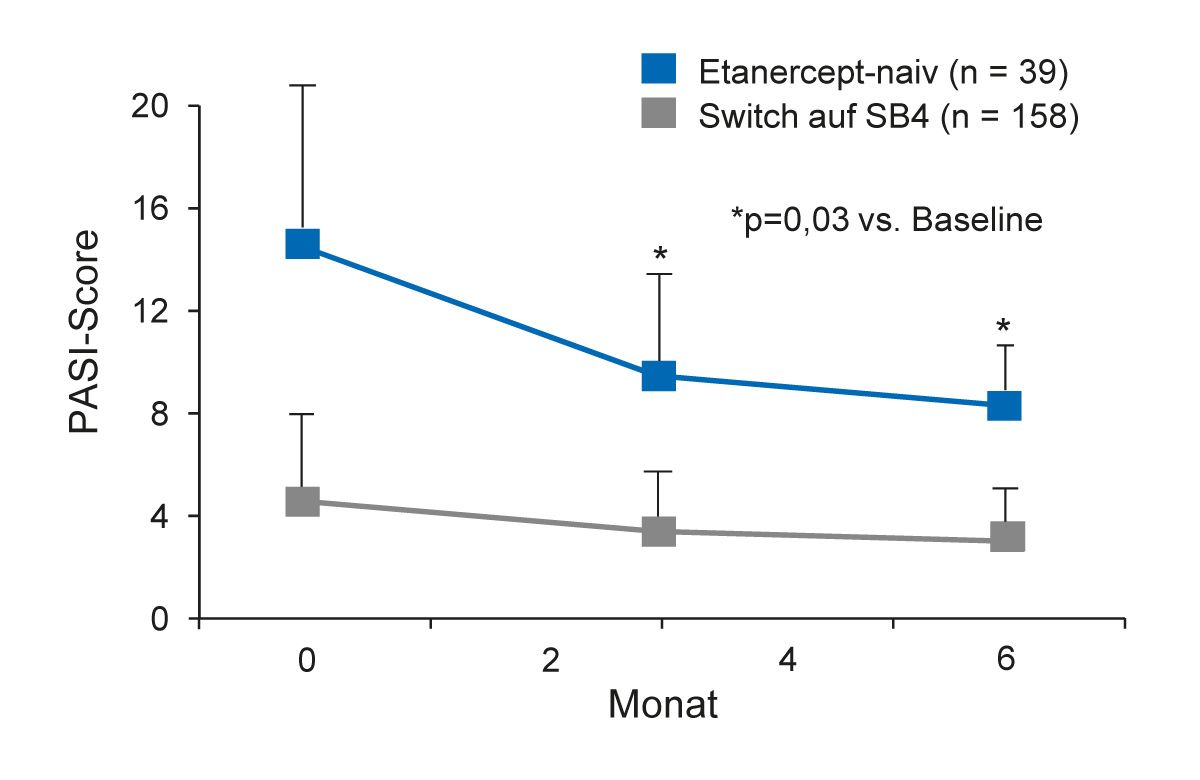
Abb. 5: Psobiosimilar-Register: PASI-Werte von Patienten, die das Etanercept-Biosimilar SB4 erhielten (Abbildung modifiziert nach [30]).
und Biosimilar SB4.
In das BADBIR-Register wurden insgesamt 189 Psoriasis-Patienten mit SB4-Therapie zwischen 2016-2018 eingeschlossen [31]. Für die Wirksamkeitsanalyse wurden Daten von 48 Patienten verwendet, von denen jeweils vollständige PASI- bzw. DLQI-Werte vorlagen [31]. Die Patienten wurden in die beiden Subgruppen PASI < 10 (n = 20) und PASI ≥ 10 (n = 28) eingeteilt. In der PASI ≥ 10-Gruppe verbesserte sich der mittlere PASI- Score um 10,7 ± 6,6 Punkte (von 15,7 ± 3,8 auf 5,0 ± 6,2). Auch der DLQI-Score verbesserte sich deutlich in der Gruppe der Patienten mit einem DLQI ≥ 10 (von 18,9 ± 5,1 auf 6,5 ± 7,2) nach 6-monatiger Therapie mit SB4. Insgesamt zeigen diese Register-Daten, dass das Etanercept-Biosimilar SB4 in der klinischen Praxis wirksam ist [31].
Ein weiteres europäisches Register ist das dänische DERMBIO-Register, welches Daten von allen Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis enthält, die in Dänemark mit Biologika behandelt wurden. Eine Analyse untersuchte die Rate von Studienabbrüchen bei Patienten, die das Original-Etanercept erhielten (n = 566) im Vergleich zum Biosimilar SB4 (n = 55) [32]. Es gab keinen signifikanten Unterschied für das Risiko von Therapie-Abbrüchen zwischen beiden Vergleichssubstanzen. Auch die Adjustierung nach Geschlecht, Methotrexat-Gabe und PsA ergab keinen signifikanten Unterschied (HR 0,50, 95 % KI [0,11-2,02]; p = 0,317). Unerwünschte Ereignisse traten ebenfalls vergleichbar häufig auf und entsprachen dem bekannten Sicherheitsprofil. Neue Sicherheitssignale wurden nicht beobachtet [32].
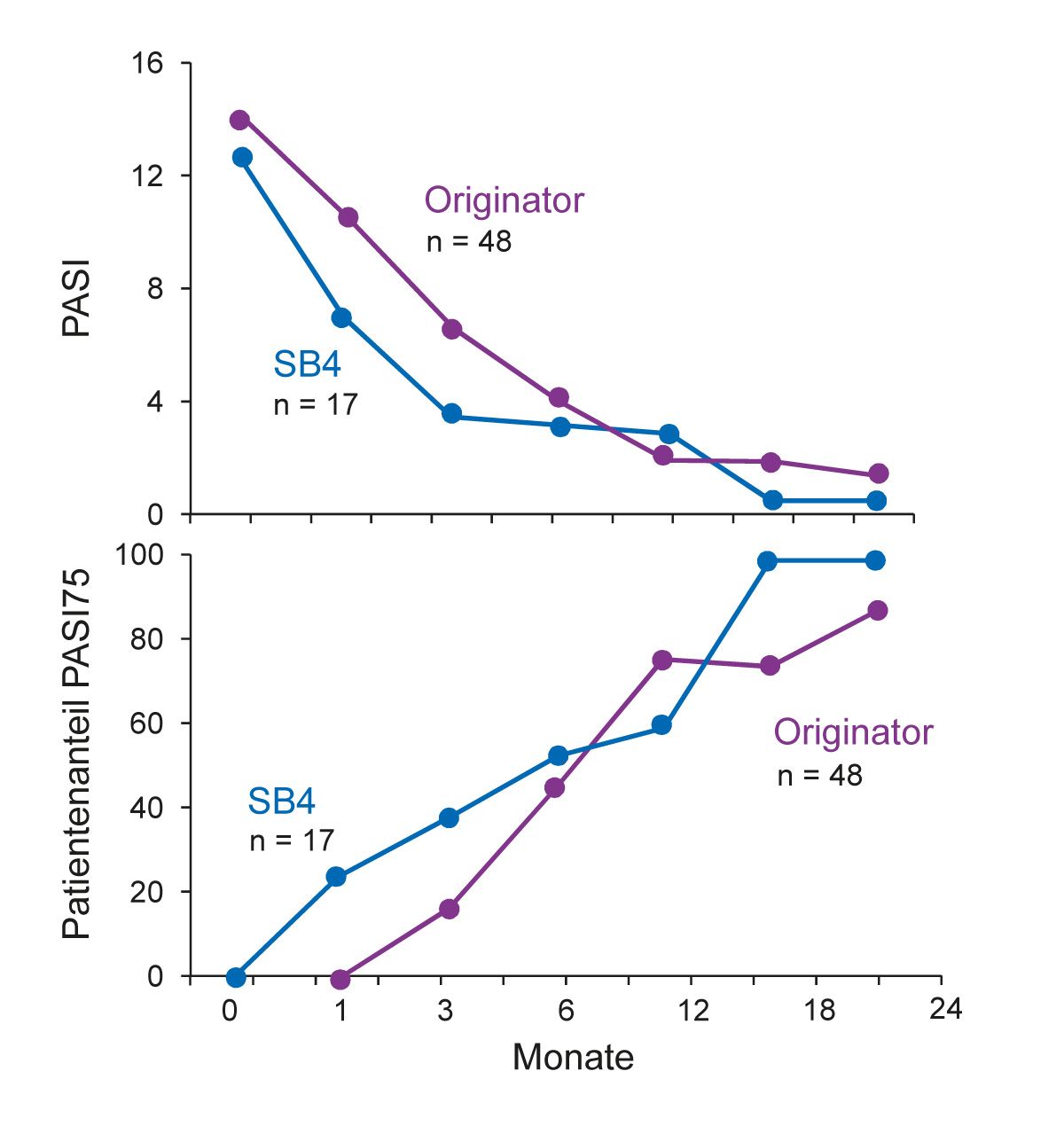
Abb. 6: Real-World-Studie: Vergleichbare Wirksamkeit des Etanercept-Biosimilars SB4 zum Origina- tor (Abbildung modifiziert nach [33])
Neben Registern liefern auch Real-World-Studien wertvolle Daten zur Wirksamkeit und Sicherheit von Arzneimitteln unter Alltagsbedingungen. In einer italienischen Real- World-Studie wurden Daten von 65 Psoriasis-Patienten mit oder ohne Psoriasis-Arthritis aus der dermatologischen Ambulanz des Sant‘Andrea Hospitals in Rom analysiert [33]. Die Patienten wurden mindestens 3 Monate lang mit dem Etanercept-Originator (n = 48) oder mit dem Biosimilar SB4 (n = 17) behandelt. Primäre Endpunkte waren absolute PASI-Werte und das Ansprechen (PASI 75 und 90). Für SB4 wurde eine vergleichbare Wirksamkeit für die absolute PASI-Reduktion sowie die Nicht-Unterlegenheit für das Ansprechen nachgewiesen (Abb. 6). Weiterhin bestätigte die Nichtunterlegenheits- Analyse die Äquivalenz für die Parameter DLQI, VAS-Juckreiz und VAS-Schmerz. Auch die Sicherheitsdaten beider Wirkstoffe waren vergleichbar und entsprachen dem bekannten Profil [33].
In Dänemark wurden infolge einer nationalen Verordnung ab November 2018 alle erwachsenen Psoriasis-Patienten vom Adalimumab-Originalpräparat auf das Biosimilar GP2017 im Osten des Landes und auf SB5 im Westen umgestellt sowie alle Kinder auf das Biosimilar ABP501. In einer Datenanalyse des DERMBIO-Registers wurden die Outcomes von erwachsenen Patienten nach Switch auf die Adalimumab-Biosimilars GP2017 und SB5 untersucht [34]. 348 Patienten, die zwischen November 2018 und Januar 2019 von einem Originalpräparat auf ein Adalimumab-Biosimilar wechselten, wurden in die Biosimilar-Kohorte aufgenommen. Davon erhielten 186 Patienten GP2017 und 162 Patienten SB5. Die Originator-Kohorte umfasste 378 Patienten, die zwischen Mai 2017 und November 2017 mit dem Adalimumab-Originalpräparat behandelt wurden. Die 1-Jahres-Retentionsraten beider Kohorten waren vergleichbar: 92,0 % für die Biosimilar- Kohorte und 92,1 % für die Originator-Kohorte (Abb. 7). Die Hazard-Ratio-Werte jeweils für Behandlungsabbruch, unzureichende Wirksamkeit und unerwünschte Ereignisse beider Kohorten waren ebenfalls ähnlich: jeweils 1,02 (95 % KI [0,61-1,70]; p = 0,94); 0,82
(95 % KI [0,39-1,73]; p = 0,60) und 1,41 (95 % KI [0,52-3,77]; p = 0,50). Insgesamt bestätigte diese Analyse des DERMBIO-Registers, dass die Wirksamkeit des Adalimumab-Biosimilars vergleichbar zum Originalpräparat ist [34].
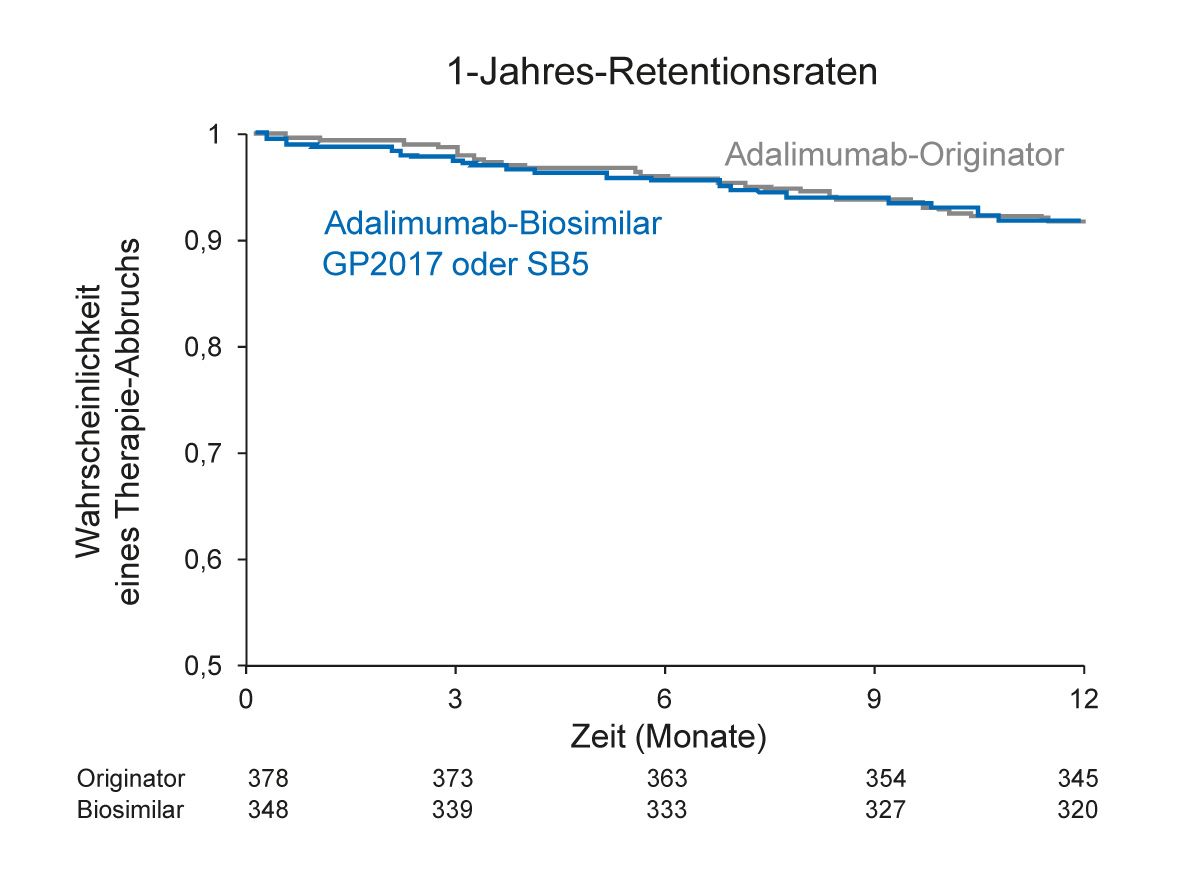
Abb. 7: DERMBIO-Register: Die Retentionsraten für Adalimumab-Biosimilars (GP2017 oder SB5) und Adalimumab-Originator waren vergleichbar (Abbildung modifiziert nach [34])
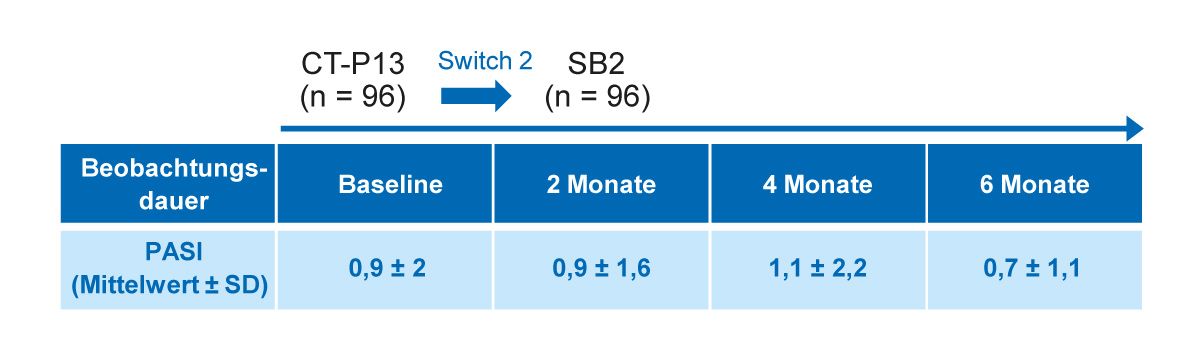
In einer weiteren italienischen Beobachtungsstudie wurde die Umstellung vom Referenz-Infliximab auf das Biosimilar SB2 bei Psoriasis-Patienten untersucht [35]. In die 6-monatige Studie wurden 96 Patienten eingeschlossen, die in den drei Universitätskliniken Verona, Padua und Modena aus nichtmedizinischen Gründen auf das jeweils verfügbare Infliximab-Biosimilar umgestellt wurden. Die Patienten wurden zunächst vom Infliximab-Originator auf das Biosimilar CT-P13 umgestellt und wechselten anschließend weiter auf das Infliximab-Biosimilar SB2. Die durchschnittliche Dauer der Behandlung mit dem Infliximab-Originator, CT-P13 bzw. SB2 betrug jeweils 97,4 ± 36,3 Monate, 17,6 ± 8 Monate und 6,5 ± 2 Monate. Während des 6-monatigen Beobachtungszeitraums blieb der mittlere PASI-Wert nach der 2. Umstellung von CT-P13 auf SB2 stabil (Tab. 4) [35].
Insgesamt weisen diese Real-World- und Register-Studien übereinstimmend darauf hin, dass die Psoriasis-Therapie mit Biosimilars unter Alltagsbedingungen genauso wirksam und verträglich ist im Vergleich zum Originator. Diese Daten aus der klinischen Praxis können daher dazu beitragen, das Vertrauen in die Therapie und somit die Verordnungen von Biosimilars zu erhöhen, so dass die Versorgung der Psoriasis-Patienten weiterhin verbessert werden kann.
Biologika-Therapie und COVID-19
für schwere Verläufe einer COVID-19-Infektion.
Zur Untersuchung der Frage, ob eine Biologika-Therapie das Risiko für schwere COVID-19-Verläufe erhöht, wurde eine französische multizentrische Studie mit 1.418 erwachsenen Patienten mit Psoriasis durchgeführt (Abb. 8) [36]. 0,35 % der Patienten der Gesamtkohorte hatten eine COVID-19-Infektion mit schwerem Verlauf, wovon bei 60 % der Patienten weitere Risikofaktoren für einen schweren Verlauf vorlagen. In den Subgruppen mit systemischer Therapie bzw. Biologika-Therapie war der Anteil an COVID-19-Infektionen vergleichbar. Es gab keinen signifikanten Unterschied der Anzahl an COVID-19-Infektionen mit schwerem Verlauf in Abhängigkeit davon, ob sich die Patienten in der Erhaltungsphase oder Initiierungsphase der Therapie befanden: p = 0,58; OR = 1,29; 95 % KI (0,03-13,4). In dieser Studie wurde kein Hinweis dafür gefunden, dass die systemische Therapie mit Biologika das Risiko für schwere COVID-19-Infektionen erhöht. Im Gegenteil vermuteten die Autoren sogar, dass die Biologika-Therapie vor einem schweren Verlauf von COVID-19-Infektionen schützen könnte [36].
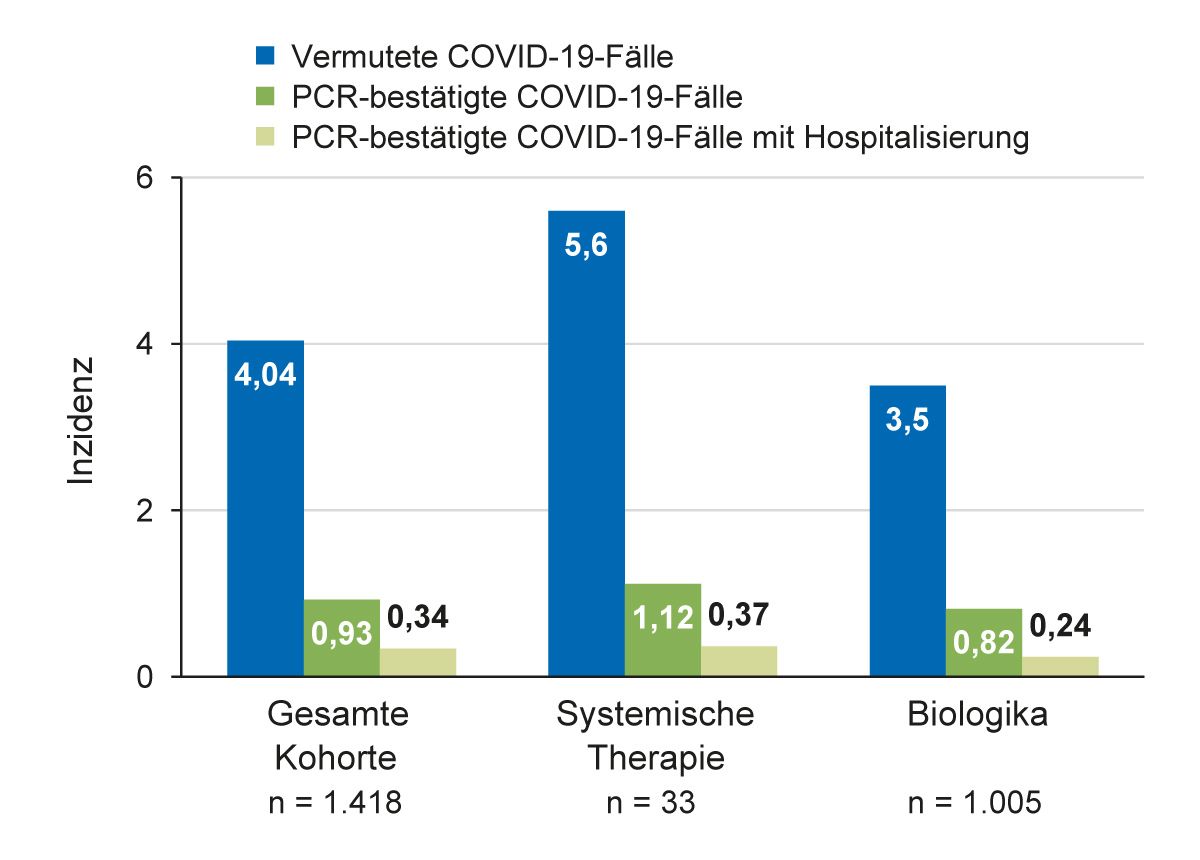
Abb. 8: Die Biologika-Therapie erhöht nicht das Risiko für einen schweren Verlauf der COVID-19-Infektion [36].
Eine monozentrische italienische Studie untersuchte ebenfalls die Frage, ob Psoriasis- Patienten mit systemischer Therapie ein höheres COVID-19-Risiko haben [37]. 1.193 Psoriasis-Patienten, die eine systemische Therapie in der Ambulanz des San-Donato- Krankenhaus in Mailand erhielten, wurden in die San-Donato-Kohorte eingeschlossen. Als Kontroll-Kohorte diente die Gesamtbevölkerung der Lombardei. Die Daten-Analyse ergab, dass Patienten mit Biologika-Therapie zwar ein signifikant höheres COVID-19-Risiko hatten im Vergleich zur Kontrolle: OR 3,43 [95 % KI 2,25-5,73], p < 0,0001.
Dagegen war aber das Risiko für eine Intensivstation-Behandlung nicht signifikant erhöht (OR 3,41 [95 % KI 0,21-54,55], p = 0,3861) und das Risiko für Todesfälle war gar nicht erhöht (OR 0,41 [95 % KI 0,03-6,59], p = 0,5306) [37].
Diese Ergebnisse weisen insgesamt darauf hin, dass die Blockade der proinflammatorischen Zytokine, die in der viralen Phase schädlich sind, in der hyperinflammatorischen Phase grundsätzlich von Vorteil sein könnte. Somit könnte die Therapie mit Biologika Patienten vor dem Fortschreiten von extrapulmonalen Manifestationen und dem Tod schützen [36, 37].
Fazit
• Psoriasis vulgaris (PsO), Psoriasis-Arthritis (PsA) und Acne Inversa (AI) sind weit verbreitete chronisch entzündliche Hautkrankheiten, die mit hoher Morbidität und Einbußen der Lebensqualität einhergehen.
• Biologika stellen seit fast 20 Jahren eine Erfolgsgeschichte bei entzündlichen Haut- krankheiten dar und führten zur wesentlichen Verbesserung der durchschnittlichen PASI- und DLQI-Werte.
Empfehlungen zum Einsatz von TNF-Inhibitoren bei PsO, PsA und AI
• PsO: Biologika werden bei mittelschweren bis schweren Formen (PASI > 10) bzw. bei leichten Formen mit Upgrade-Kriterien empfohlen, wenn konventionelle Therapien keinen ausreichenden Erfolg erwarten lassen. Die TNF-Inhibitoren Adalimumab und Certolizumab pegol haben eine Firstline-Zulassung, Etanercept und Infliximab eine Secondline-Zulassung.
• PsA: Die Biologika-Therapie ist bei allen Manifestationen möglich. TNF-Inhibitoren als Firstline-Therapie haben sich bewährt bei aktiver Enthesitis, Nagelbeteiligung oder Daktylitis sowie bei axialer Beteiligung und unzureichendem Ansprechen auf NSAR.
• AI: Der TNF-Inhibitor Adalimumab ist die einzige explizit zugelassene Therapie zur Behandlung der mittelschweren bis schweren aktiven AI bei Erwachsenen und Jugendlichen ab 12 Jahren.
Die Einführung der Biosimilars hat aufgrund von Kosteneinsparungen das Potenzial, die Versorgung der Patienten weiter zu verbessern. Neben klinischen Studien bestätigten inzwischen auch eine zunehmende Anzahl an europäischen Registern und Real-World- Studien übereinstimmend die Wirksamkeit und das Sicherheitsprofil der Biosimilars zu Etanercept, Infliximab und Adalimumab in der klinischen Praxis. Die Biosimilars zu Etanercept, Infliximab und Adalimumab sind eine kostengünstige und gleichwertige Alternative zu den Original-Biologika. Biologika scheinen das Risiko für schwere COVID- 19-Verläufe nicht zu erhöhen, sondern könnten in der hyperinflammatorischen Phase sogar von Vorteil sein.
Abkürzungen
AI Acne inversa
BADBIR British Association of Dermatologists Biologic and Immunomodulators Register BASDAI Bath ankylosing spondylitis disease activity index
BSA Befallene Körperoberfläche (Body surface Area)
BSTOP Biomarkers of Systemic Treatment Outcomes in Psoriasis CED Chronisch-entzündliche Darmkrankheiten
CME Continuing Medical Education DAS28 Disease Activity Score 28 DLQI Dermatology Life Quality Index
csDMARD konventionelle krankheitsmodifizierende Therapie EULAR European League Against Rheumatism
GRAPPA Group for Research and Assessment of Psoriasis and Psoriatic Arthritis HS Hidradenitis suppurativa
HR Hazard Ratio
IL Interleukin
i.v. intravenös
JAK Januskinase
JAKi Januskinase-Inhibitor
KI Konfidenzintervall
MTX Methotrexat
NSAR Nichtsteroidale Antirheumatika PASI Psoriasis Area and Severity Index PDE-4 Phosphodiesterase-4
PDE4i Phosphodiesterase-4-Inhibitor PsA Psoriasis-Arthritis
PsO Psoriasis vulgaris
s.c. subkutan
TNF Tumornekrosefaktor
TNFi Tumornekrosefaktor-Inhibitor RA Rheumatoide Arthritis
VAS Visuelle Analog-Skala
vs. versus
Quellen
1. Augustin M, Reich K, Glaeske G et al. Co-morbidity and age-related prevalence of psoriasis: Analysis of health insurance data in Germany. Acta Derm Venereol. 2010; 90(2):147-51.
2. Augustin M, Glaeske G, and Hagenström K. Psoriasisreport: Ergebnisse von Routinedaten-Analysen der Techniker Krankenkasse aus den Jahren 2017–2019. Available from: https://www.tk.de/resource/blob/2105142/9fc664ddbfa42 f94c3796a2211469f7f/hautreport-psoriasis-lang-data.pdf.
3. Mulder MLM, Van Hal TW, Wenink MH et al. Clinical, laboratory, and genetic markers for the development or presence of psoriatic arthritis in psoriasis patients: a systematic review. Arthritis Res Ther. 2021; 23(1):168.
4. Deike M, Brinks R, Meller S et al. Risk of psoriatic arthritis depending on age: analysis of data from 65 million people on statutory insurance in Germany. RMD Open. 2021; 7(3).
5. Taylor W, Gladman D, Helliwell P et al. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum. 2006; 54(8):2665-73.
6. Augustin M and Radtke M. Arzneimitteltherapie der Psoriasis-Arthritis. Arzneimitteltherapie 2017; 35(07):244-57.
7. Kirsten N, Zander N, and Augustin M. Prevalence and cutaneous comorbidities of hidradenitis suppurativa in the German working population. Arch Dermatol Res. 2021; 313(2):95-99.
8. Phan K, Charlton O, and Smith SD. Hidradenitis suppurativa and metabolic syndrome – systematic review and adjusted meta-analysis. Int J Dermatol. 2019; 58(10):1112-1117.
9. Nast A, Altenburg A, Augustin M et al. Deutsche S3-Leitlinie zur Therapie der Psoriasis vulgaris, adaptiert von EuroGuiDerm – Teil 1: Therapieziele und Therapieempfehlungen. J Dtsch Dermatol Ges. 2021; 19(6):934-951.
10. Mrowietz U, Kragballe K, Reich K et al. Definition of treatment goals for moderate to severe psoriasis: a European consensus. Arch Dermatol Res. 2011; 303(1):1-10.
11. Kiedrowski R, Dirschka T, Krähn-Senftleben G et al. Aktualisierter praxisnaher Behandlungs- pfad. 2019; Available from: https://www.onkoderm.de/wp-content/uploads/sites/109/2019/09/ onkoderm_Behandlungspfad_Psoriasis_2019_E3.pdf
12. Fachinformation. Available from: www.fachinfo.de.
13. Armstrong AW, Puig L, Joshi A et al. Comparison of Biologics and Oral Treatments for Plaque Psoriasis: A Meta- analysis. JAMA Dermatol. 2020; 156(3):258-269.
14. Coates LC, Kavanaugh A, Mease PJ et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 Treatment Recommendations for Psoriatic Arthritis. Arthritis Rheumatol. 2016; 68(5):1060-71.
15. Coates LC, Corp N, Van Der Windt DA et al. GRAPPA Treatment Recommendations: 2021 Update. J Rheumatol. 2022.
16. Sartorius K, Lapins J, Emtestam L et al. Suggestions for uniform outcome variables when reporting treatment effects in hidradenitis suppurativa. Br J Dermatol. 2003; 149(1):211-3.
17. Kurzen H, Fritz K, and Altenburg A. [Hidradenitis suppurativa/acne inversa in daily practice]. Hautarzt. 2021; 72(8):706-714.
18. Carswell EA, Old LJ, Kassel RL et al. An endotoxin-induced serum factor that causes necrosis of tumors. Proc Natl Acad Sci U S A. 1975; 72(9):3666-70.
19. Armuzzi A, Lionetti P, Blandizzi C et al. anti-TNF agents as therapeutic choice in immune-mediated inflammatory diseases: focus on adalimumab. Int J Immunopathol Pharmacol. 2014; 27(1 Suppl):11-32.
20. Conrad C and Gilliet M. Psoriasis: from Pathogenesis to Targeted Therapies. Clin Rev Allergy Immunol. 2018; 54(1):102-113.
21. Albanesi C, Madonna S, Gisondi P et al. The Interplay Between Keratinocytes and Immune Cells in the Pathogenesis of Psoriasis. Front Immunol. 2018; 9:1549.
22. Phillipp S, Ludwig N, Sterry W et al. Biologics als neue Therapieoptionen in der Behandlung der Psoriasis und Psoriasis- Arthritis. Akt Dermatol. 2006;32:9.
23. Volc S and Ghoreschi K. Pathophysiologische Grundlagen der Systemtherapien bei Psoriasis. J Dtsch Dermatol Ges. 2016; 14(6):557-73.
24. European Medicines Agency. Guideline on similar biological medicinal products.
25. Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ). Biosimilars. Leitfaden der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ). 2. Auflage, Version 1.0. Januar 2021. Available from: https://www.akdae.de/Arzneimit- teltherapie/LF/PDF/Biosimilars.pdf.
26. Vogler S, Schneider P, Zuba M et al. Policies to Encourage the Use of Biosimilars in European Countries and Their Potential Impact on Pharmaceutical Expenditure. Front Pharmacol. 2021; 12:625296.
27. Prignano F, Choi J, Pieper B et al. Anti-tumor necrosis factor agents in psoriasis: addressing key challenges using biosimilars. Expert Opin Biol Ther. 2021; 21(1):75-80.
28. Augustin M, Garbe C, Neitemeier S et al. [Regional variations in healthcare for patients with psoriasis and atopic dermatitis in Germany]. Hautarzt. 2022; 73(1):27-39.
29. Gisondi P, Bianchi L, Conti A et al. Infliximab biosimilar CT-P13 in the treatment of chronic plaque psoriasis: data from the Psobiosimilars registry. Br J Dermatol. 2017; 177(6):e325-e326.
30. Gisondi P, Bianchi L, Calzavara-Pinton P et al. Etanercept biosimilar SB4 in the treatment of chronic plaque psoriasis: data from the Psobiosimilars registry. Br J Dermatol. 2019; 180(2):409-410.
31. Egeberg A, Girolomoni G, Feldman SR et al. Real World SB4 (Etanercept Biosimilar) Use in Patients With Psoriasis: Data from the British Association of Dermatologists Biologic Interventions Register (BADBIR). J Drugs Dermatol. 2020; 19(3):316-318.
32. Egeberg A, Ottosen MB, Gniadecki R et al. Safety, efficacy and drug survival of biologics and biosimilars for moderate- to-severe plaque psoriasis. Br J Dermatol. 2018; 178(2):509-519.
33. Giordano D, Capalbo A, Gagliostro N et al. Biosimilar versus originator etanercept: a real-life clinical study. Ital J Dermatol Venerol. 2022.
34. Loft N, Egeberg A, Rasmussen MK et al. Outcomes Following a Mandatory Nonmedical Switch From Adalimumab Originator to Adalimumab Biosimilars in Patients With Psoriasis. JAMA Dermatol. 2021; 157(6):676-683.
35. Gisondi P, Virga C, Piaserico S et al. Switching from one infliximab biosimilar (CT-P13) to another infliximab biosimilar (SB2) in patients with chronic plaque psoriasis. Br J Dermatol. 2020; 183(2):397-398.
36. Fougerousse AC, Perrussel M, Bécherel PA et al. Systemic or biologic treatment in psoriasis patients does not increase the risk of a severe form of COVID-19. J Eur Acad Dermatol Venereol. 2020; 34(11):e676-e679.
37. Damiani G, Pacifico A, Bragazzi NL et al. Biologics increase the risk of SARS-CoV-2 infection and hospitalization, but not ICU admission and death: Real-life data from a large cohort during red-zone declaration. Dermatol Ther. 2020; 33(5):e13475.
Bildquellen
Titel: © RFBSIP – stock.adobe.com



Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der arztCME-Online-Akademie erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.