Lymphödem: Pathophysiologie, Diagnostik und Therapie
Interessengebiete: Allgemeinmedizin und Innere Medizin, Haut- und Geschlechtskrankheiten, Orthopädie
Das Lymphödem ist eine chronische Erkrankung, bei der sich Lymphflüssigkeit im Interstitium ansammelt. In der Folge kommt es zu persistierenden Schwellungen. Meist betrifft das Lymphödem die Extremitäten, es kann aber auch im Gesicht, Hals, Genitalbereich oder Rumpf auftreten. Im Gegensatz zum primären Lymphödem entsteht das sekundäre Lymphödem durch erworbene Schäden am lymphatischen System. Häufig sind chirurgische Eingriffe mit Lymphknotenentfernung, Strahlentherapie, Traumata, Infektionen oder entzündliche Erkrankungen ursächlich.
Diese CME gibt einen Überblick zu Pathophysiologie, Diagnostik und Therapie beim Lymphödem.
Kursinhalt
Inhaltsverzeichnis
Einleitung
Das Lymphödem ist eine chronische Erkrankung, die durch eine Ansammlung von Lymphflüssigkeit im Interstitium gekennzeichnet ist und zu persistierenden Schwellungen führt [1].
Genaue Zahlen über das Auftreten des sekundären Lymphödems sind schwer zu ermitteln und die Ursachen sind weltweit sehr verschieden. In Industriestaaten dürfte die Inzidenz des sekundären Lymphödems bei 0,13-2 % liegen [2]. Das sekundäre Lymphödem tritt häufig als Komplikation nach onkologischen Eingriffen auf, insbesondere bei Brustkrebspatientinnen nach axillärer Lymphknotendissektion und Strahlentherapie [3]. In Deutschland leiden geschätzt etwa 3-4 Millionen Menschen an einem Lymphödem, was die Relevanz dieser Erkrankung in der klinischen Praxis unterstreicht.
Das Lymphödem hat erhebliche Auswirkungen auf die Lebensqualität der Betroffenen und ist mit einem erhöhten Risiko für Infektionen wie Erysipel verbunden. Eine frühzeitige Diagnose und ein effektives Management sind entscheidend, um Progressionen und Komplikationen zu vermeiden [4].
Pathophysiologie
Das Lymphödem entsteht durch ein Ungleichgewicht zwischen der Lymphbildung und dem Lymphabfluss, was zu einer Akkumulation von proteinreicher Flüssigkeit im Interstitium führt [5]. Dieses Ungleichgewicht kann auf strukturelle oder funktionelle Defekte im lymphatischen System zurückgeführt werden.
Primäres vs. sekundäres Lymphödem
Ein primäres Lymphödem ist das Ergebnis angeborener oder genetisch bedingter Fehlbildungen des lymphatischen Systems. Es kann isoliert auftreten oder Teil eines Syndroms sein [6]. Diese Fehlbildungen führen zu einer verminderten Anzahl oder Funktion der Lymphgefäße, was den Lymphtransport beeinträchtigt.
Das sekundäre Lymphödem entsteht durch erworbene Schäden am lymphatischen System. Häufige Ursachen sind chirurgische Eingriffe mit Lymphknotenentfernung, Strahlentherapie, Traumata, Infektionen oder entzündliche Erkrankungen. Sekundäre Lymphödeme treten häufig erst nach einer Latenzzeit auf und beginnen eher zentral. Mit 66-75 % stellen sie den weitaus größten Anteil aller Lymphödeme [7].
Die ICD-10 ermöglicht eine nach Lokalisationen differenzierte und zum großen Teil stadienbezogene Kodierung lymphologischer Krankheitsbilder. Obwohl hierdurch im klinischen Alltag ein erhöhter Arbeitsaufwand besteht, sollte diese Möglichkeit genutzt werden, um den stadienabhängig unterschiedlichen Behandlungsaufwand exakt abzubilden [2] (Abb. 1).
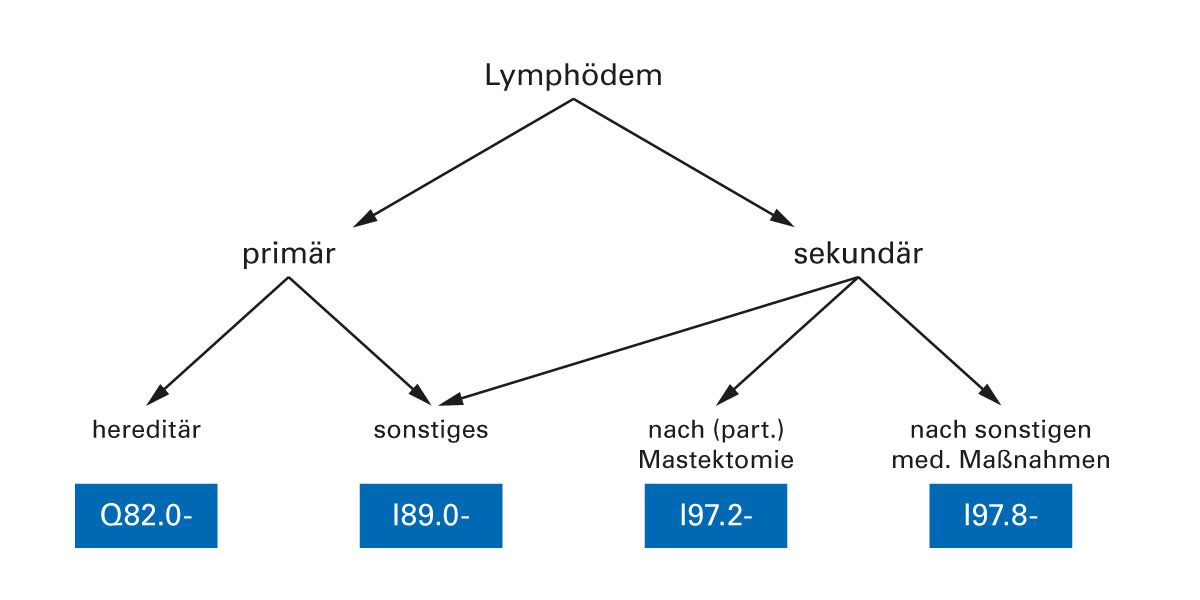
Abb. 1: Klassifikationssystematik des Lymphödems [adaptiert nach 2]
Zelluläre und molekulare Mechanismen
Die Pathophysiologie des Lymphödems lässt sich in zwei Hauptbereiche unterteilen: die Entstehung des Ödems und die daraus resultierenden Folgeschäden und Gewebeumbauten.
Lymphödeme resultieren aus einem Ungleichgewicht von anfallender lymphpflichtiger Last und der Transportkapazität des Lymphgefäßsystems. Klinisch präsentiert sich das Lymphödem als Schwellung der betroffenen Areale, meist der Extremitäten.
Die Entstehung eines Lymphödems beruht auf einem Ungleichgewicht zwischen der lymphpflichtigen Last und der Transportkapazität des Lymphsystems. Die lymphpflichtige Last umfasst Wasser, Eiweiße, Fette und Zellen, die aus dem Gewebe abtransportiert werden müssen. Wenn die Transportkapazität des Lymphsystems nicht ausreicht, um diese Last zu bewältigen, staut sich die Lymphe im Gewebe.
Die anhaltende Ansammlung von Lymphe führt zu verschiedenen pathologischen Veränderungen im betroffenen Gewebe [8, 9]. Etwa 10 % der interstitiellen Flüssigkeit sind über Lymphkapillaren mit dem venösen Rückfluss verbunden. Eine Schädigung der Lymphgefäße führt zu einer Stauung der Lymphflüssigkeit, was durch drei Mechanismen zum klinischen Zustand des Lymphödems führt [10]:
- Entzündung unter Beteiligung von CD4+-T-Zellen als Hauptfaktor, zusammen mit den Auswirkungen von Immunzellen auf die VEGF-C / VEGFR-Achse, was zu einer abnormalen Lymphangiogenese führt.
- Gewebefibrose, die durch die Überaktivität von Th2-Zellen ausgelöst wird und zur Ausschüttung profibrotischer Zytokine wie IL-4, IL-13 und des Wachstumsfaktors TGF-β1 führt.
- Adipozytenhypertrophie und Ablagerung von Fettgewebe, die durch die Interaktion von CCAAT / enhancer-bindendes Protein α und Peroxisom-Proliferator-aktivierter Rezeptor-γ reguliert wird.
Es wird diskutiert, dass Adipositas-assoziierte Lymphödeme bei morbider Adipositas inzwischen die größte Gruppe unter den sekundären Lymphödemen bilden und eine eigene Entität darstellen [7]. Es ist wichtig zu wissen, dass alle Lymphödeme, auch primäre und postoperative sekundäre durch eine Adipositas ungünstig beeinflusst werden [11].
Klinisches Bild
Das klinische Bild des Lymphödems ist gekennzeichnet durch eine anhaltende Schwellung eines oder mehrerer Körperteile infolge einer gestörten Lymphdrainage. Typischerweise betrifft das Lymphödem die Extremitäten, kann aber auch im Gesicht, Hals, Genitalbereich oder Rumpf auftreten.
Symptome und klinische Zeichen
Die initialen Symptome eines Lymphödems können subtil sein und beinhalten ein Gefühl von Schwere, Spannungsgefühl oder Müdigkeit in der betroffenen Extremität. Beim primären Lymphödem ist der aszendierende Verlauf (beim Beinbeginn an den Zehen und am Fußrücken) typisch, beim sekundären Lymphödem zeigt sich nicht selten ein deszendierender Verlauf (beim Bein Schwellungen vor allem auch des Oberschenkels). Allerdings wird auch beim sekundären Lymphödem häufig eine Vorfußschwellung bzw. Zehenschwellung beobachtet. Beide Formen von Lymphödemen sind in der Regel schmerzfrei.
Mit fortschreitender Erkrankung treten sichtbare Schwellungen auf, die zunächst weich und eindrückbar sind (Pitting-Ödem). Im weiteren Verlauf kann es zur Verhärtung des Gewebes (Fibrose) und zur Ausbildung von trophischen Hautveränderungen kommen [12]. Charakteristische klinische Zeichen umfassen:
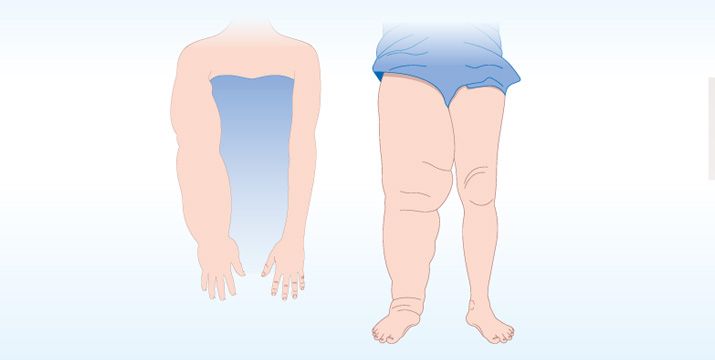
- Asymmetrische Schwellung: Im Gegensatz zu anderen Ödemformen ist das Lymphödem häufig unilateral (Abb. 2) oder asymmetrisch verteilt.
- Positive Umfangsdifferenz: Messbare Umfangsvermehrung der betroffenen Extremität im Vergleich zur Gegenseite.
- Hautveränderungen: Hyperkeratose, Papillomatosis cutis lymphostatica, Lichenifikation, Fibrose, Hyperpigmentierungen. Am Übergang vom Unterschenkel zum Fußrücken und zwischen Vorfuß und Zehen kommt es zur Ausbildung tiefer Hautfalten.
- Stemmer-Zeichen: Eine Verdickung der Hautfalte über den Zehen oder Fingern, die nicht abhebbar ist, gilt als spezifisches Zeichen für ein Lymphödem.
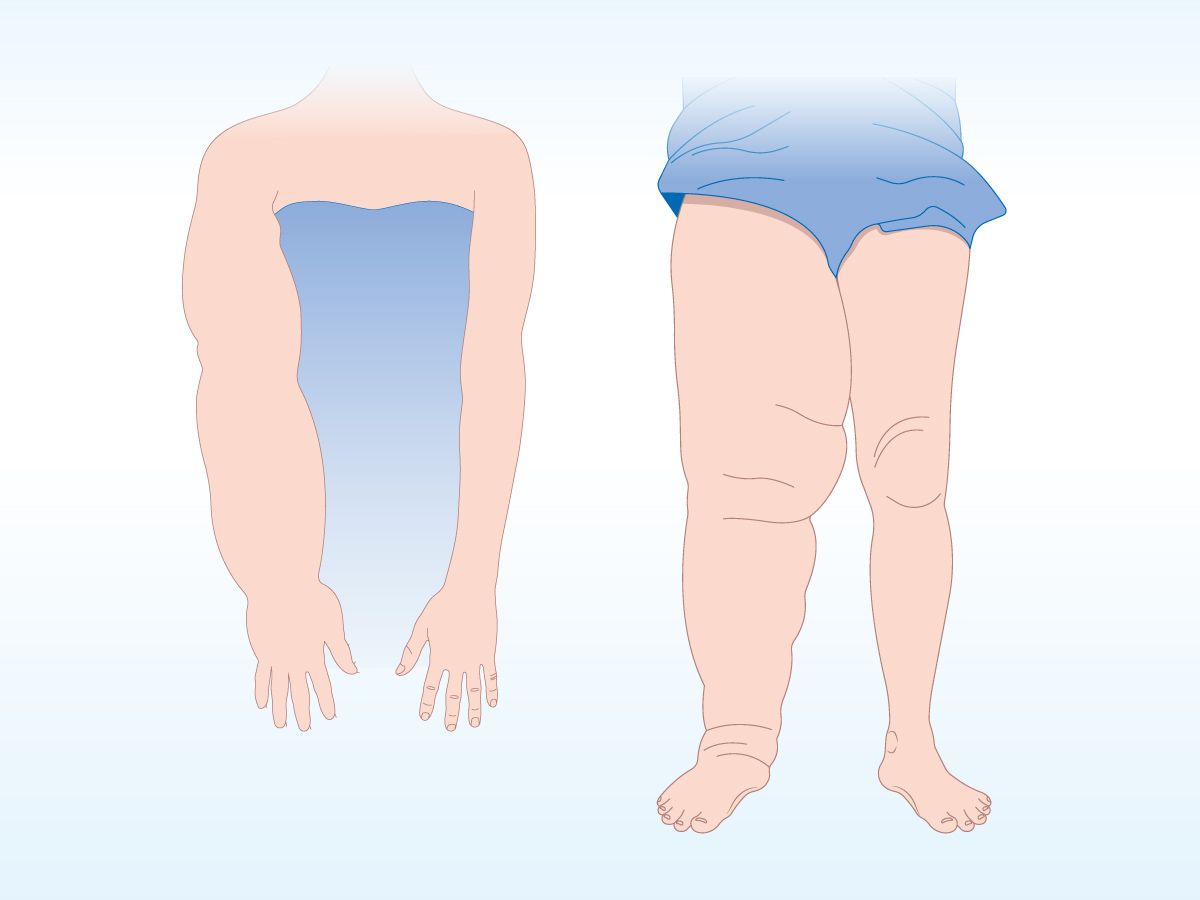
Abb. 2: Das Lymphödem ist häufig unilateral oder asymmetrisch verteilt
Stadien und Klassifikationssysteme
Das Lymphödem wird häufig in verschiedene Stadien eingeteilt, basierend auf der klinischen Präsentation und der Reversibilität der Schwellung [2]:
- Stadium 0 (Latenzstadium): Subklinisches Stadium. Kein klinisch apparentes Lymphödem, aber zum Teil pathologisches Lymphszintigramm.
- Stadium I: (spontan reversibel). Ödem von weicher Konsistenz, Hochlagern reduziert die Schwellung.
- Stadium II: (nicht spontan reversibel) Ödem mit sekundären Gewebeveränderungen; Hochlagern beseitigt die Schwellung nicht.
- Stadium III: Deformierende harte Schwellung, z. T. lobäre Form z. T. mit typischen Hautveränderungen.
Zusätzlich zur Stadieneinteilung wird oft die Klassifikation nach der International Society of Lymphology (ISL) verwendet, die ähnliche Kriterien beinhaltet [13].
Komplikationen
Ein unbehandeltes Lymphödem kann zu einer Reihe von Komplikationen führen, die sowohl das körperliche als auch das psychische Wohlbefinden der Betroffenen erheblich beeinträchtigen können. Zu den wichtigsten Komplikationen gehören [2]:
- Erysipel (Abb. 3) ist eine bakterielle Hautinfektion, die häufig durch Streptokokken verursacht wird. Bei Patienten mit Lymphödem ist das Risiko für Erysipel erhöht , da die gestörte Lymphzirkulation die Immunabwehr im betroffenen Gewebe schwächt. Unbehandelt kann ein Erysipel zu einer Sepsis führen und die Lymphgefäße weiter schädigen, was das Lymphödem verschlimmert.
- Mykosen treten aufgrund der geschwächten Immunabwehr und der gestörten Hautbarriere häufig auf. Diese Infektionen können sich schnell ausbreiten und sind oft schwer zu behandeln, da die Heilungsbedingungen durch das Lymphödem erschwert werden.
- Lymphfisteln entstehen, wenn der Druck in den Lymphgefäßen so hoch wird, dass sie aufbrechen und Lymphe austritt. Dies führt zu einem erheblichen Flüssigkeitsund Proteinverlust. Lymphfisteln sind körperlich belastend und erfordern eine intensive medizinische Behandlung, um Sekundärinfektionen zu verhindern.
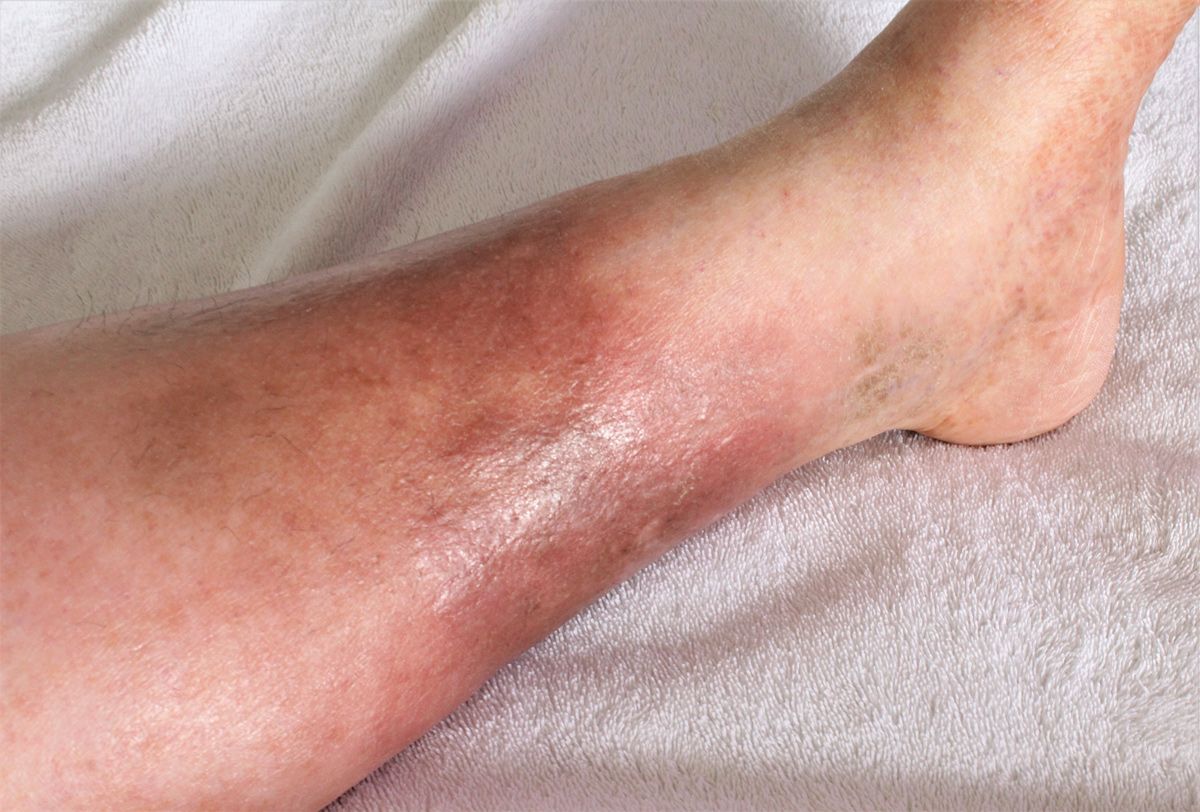
Abb. 3: Lymphödem-Patienten haben ein erhöhtes Risiko für ein Erysipel
Diagnostik
Die Diagnostik umfasst eine sorgfältige Anamnese, eine gründliche körperliche Untersuchung sowie den Einsatz verschiedener bildgebender und laborchemischer Verfahren.
Anamnese und körperliche Untersuchung
Klinisch manifeste Lymphödeme lassen sich in der Regel mit Anamnese, Inspektion, Palpation und Volumenmessung ausreichend diagnostizieren. Allerdings sollte zur Erstuntersuchung immer auch eine Duplexsonografie der Venen erfolgen. Ziel hierbei ist der Nachweis von Veneninsuffizienzen sowohl im oberflächlichen als auch im tiefen Venensystem.
Wichtige Aspekte bei der Anamnese sind [12]:
- familiäre Vorgeschichte
- vorausgegangene Operationen oder Traumata (Eingriffe mit Lymphknotenentfernung, Strahlentherapie)
- Infektionen: wiederholte Erysipele, Lymphangitiden
Die körperliche Untersuchung sollte die Beurteilung von Schwellungen, Hautveränderungen, Asymmetrien und trophischen Veränderungen, die Palpation des subkutanen Gewebes sowie vergleichende Messungen der betroffenen und nicht betroffenen Extremität zur Quantifizierung des Ödems umfassen.
Ein positives Stemmer-Zeichen gilt als spezifisch für ein Lymphödem [14]. Zur Prüfung der Gewebekonsistenz in der Nähe des Grundgelenks der zweiten Zehe oder des Zeigefingers eine Hautfalte abheben. Bei einem negativen Stemmerzeichen lässt sich eine schmale Hautfalte abheben, bei einem, positiven Stemmer-Zeichen nur eine verbreiterte oder gar keine Hautfalte [14, 15].
Bildgebende Verfahren
Eine bildgebende Diagnostik für das Lymphödem ist an sich nicht erforderlich. Die Lymphszintigrafie wird als Routineuntersuchung heutzutage nur noch sehr selten durchgeführt. In der klinischen Routine ist die Sonografie ein häufig eingesetztes Verfahren in der Diagnostik des Extremitäten-Lymphödems.
Hierbei wird einerseits das Lymphödem selber (echoarme Spalten im Ödemstadium, Verbreiterung und vermehrte Echogenität der Kutis und Subkutis im Fibrosestadium) untersucht, andererseits werden auch Differenzialdiagnosen, insbesondere Erkrankungen der oberflächlichen und tiefen Beinvenen, abgeklärt. Zum Ausschluss einer malignen Grunderkrankung kommen Sonografie, MRT und CT in Betracht [16-18].
Laboruntersuchungen
Obwohl Laboruntersuchungen beim Lymphödem nicht spezifisch sind, können sie zur Ausschlussdiagnostik beitragen. Die Erhöhung von Leukozyten und CRP kann auf eine Infektion hinweisen, Nieren- und Leberfunktionsparameter dienen dem Ausschluss systemischer Ursachen für Ödeme wie Nieren- oder Leberinsuffizienz und thyreoidale Parameter bei Verdacht auf eine Hypothyreose als Ursache eines generalisierten Myxödems.
Differenzialdiagnostik
Die Differenzialdiagnose des Lymphödems ist umfangreich und umfasst verschiedene Erkrankungen, die ebenfalls mit Schwellungen einhergehen [19]:
- Phlebödem: Durch chronisch-venöse Insuffizienz bedingtes Ödem, häufig begleitet von Varikosis und Hautveränderungen wie Hyperpigmentierung [20].
- Lipödem: Symmetrische Fettgewebsvermehrung an Beinen und / oder Armen, überwiegend bei Frauen. Leitsymptom sind Schmerzen; Hände und Füße sind typischerweise nicht betroffen [21].
- Herzinsuffizienz: Generalisierte Ödeme infolge kardialer Dekompensation, oft mit begleitender Dyspnoe und anderen Herzinsuffizienzzeichen.
- Niereninsuffizienz: Ödeme durch hypoalbuminämische Zustände, häufig periorbital und morgens ausgeprägt.
- Hypothyreose: Myxödeme mit teigiger Haut und systemischen Symptomen wie Müdigkeit und Kälteintoleranz.
- Infektionen und Entzündungen: Erysipel kann sowohl eine Ursache als auch eine Komplikation des Lymphödems sein und ist durch akute Entzündungszeichen gekennzeichnet.
- Tumorbedingte Lymphabflussstörungen: Maligne Prozesse können durch Infiltration oder Kompression der Lymphbahnen ein Lymphödem verursachen.
Eine gründliche Anamnese und körperliche Untersuchung sind essenziell, um die Ursache der Schwellung zu identifizieren und eine adäquate Therapie zu planen.
Therapieansätze
Die Behandlung des Lymphödems zielt darauf ab, die Lymphdrainage zu verbessern, Schwellungen zu reduzieren und Komplikationen zu verhindern [22]. Ein multidisziplinärer Ansatz ist oft erforderlich, der konservative Maßnahmen, physikalische Therapien, medikamentöse Behandlungen und chirurgische Interventionen umfasst.
Komplexe Physikalische Entstauungstherapie (KPE)
Die Komplexe Physikalische Entstauungstherapie gilt als Goldstandard in der Behandlung des Lymphödems. Sie basiert auf vier Therapiekomponenten, die synergistisch wirken [2, 23] und im Folgenden detailliert beschrieben werden. Die KPE ist eine 2-Phasen-Therapie: Phase I bezweckt die Mobilisierung der vermehrten interstitiellen Flüssigkeit mit dem Ziel der Normalisierung der Gewebshomöostase. In Phase II wird der Therapieerfolg konserviert und optimiert [2].
In Phase I der Therapie werden alle Komponenten der KPE möglichst täglich ein- bis zweimal angewandt. Die Behandlung erfolgt in spezialisierten Einrichtungen mit entsprechenden Infrastrukturen, stationär oder ambulant. In Phase II kommen die Komponenten der KPE befundadaptiert zur Anwendung. Je nach Krankheitsverlauf kann eine Wiederholung der Phase I erforderlich sein [2].
Manuelle Lymphdrainage (MLD)
Die manuelle Lymphdrainage zielt darauf ab, die lymphatische Transportkapazität zu erhöhen und Ödeme zu reduzieren [12, 22]. Durch die rhythmischen, kreisenden Bewegungen wird das Lymphgefäßsystem stimuliert, was zu einer Reduktion der Ödeme führt. Sie sollte aber nicht alleine zur Behandlung des Lymphödems eingesetzt werden, da es innerhalb weniger Stunden ohne Kompression zu einer erneuten Ödemzunahme kommt [2].
In Deutschland ist die Verordnung von MLD durch den behandelnden Arzt erforderlich. Dabei muss der Arzt die Diagnose nach ICD-10 verschlüsseln und die entsprechende Heilmittelverordnung ausstellen. Wichtig ist, dass die Verordnung die genaue Angabe der Behandlungsfrequenz und -dauer enthält. Gemäß Heilmittelkatalog müssen bestimmte Kriterien erfüllt sein, und es gibt Höchstwerte für die Verordnung von MLD, die beachtet werden müssen [24].
Kompressionstherapie
Die Kompressionstherapie ist ein weiterer Eckpfeiler in der Behandlung des Lymphödems [23]. Ihre Wirkungen werden in der Leitlinie wie folgt beschrieben [2]:
- Normalisierung einer pathologisch erhöhten Ultrafiltration mit konsekutiver Reduzierung der lymphpflichtigen Last
- verstärkter Einstrom der interstitiellen Flüssigkeit in die initialen Lymphgefäße
- Verschiebung der Flüssigkeit durch die Gewebsspalten
- Erhöhung des Lymphflusses in den noch funktionierenden Lymphgefäßen
- Reduzierung des venösen Druckes und damit eine antiödematöse Wirkung
- Verbesserung der Gewebebefunde in der Phase II
Die Phasen der Kompressionstherapie werden wie folgt beschrieben:
- Phase I: Entstauungsphase. In dieser initialen Phase werden mehrlagige, kurzzugige Kompressionsbandagen angelegt, um das Ödemvolumen effektiv zu reduzieren. Die Bandagierung erfolgt in der Regel unmittelbar nach der MLD und wird täglich erneuert.
- Phase II: Erhaltungs- und Optimierungsphase. Nach Erreichen der maximalen Entstauung wird auf flachgestrickte Kompressionsstrümpfe umgestellt, die individuell angepasst werden. Sie dienen der Volumenerhaltung und verhindern ein erneutes Anschwellen. Bezüglich Dehnbarkeit entsprechen diese im Wesentlichen textilelastischen Binden.
Medizinische Kompressionsstrümpfe (MKS) werden in vier Kompressionsklassen unterteilt (CCL 1 bis CCL4). Je höher die Klasse, desto intensiver der vom Gestrick ausgeübte Kompressionsdruck. Genauer gesagt handelt es sich um den Anpressdruck im Fesselbereich, der üblicherweise in den Einheiten kPA (Kilopascal) oder mmHg (Millimeter Quecksilbersäule) angegeben wird. Der Druck von 18-21 mmHg entspricht beispielsweise der Kompressionsklasse I.
Beim Lymphödem lassen sich grundsätzlich keine bestimmten Kompressionsklassen zuordnen, sondern es sind individuelle Faktoren zu berücksichtigen. Dazu gehören:
- der zu versorgende Körperbereich
- Stadium des Ödems und Ausprägung der Symptome
- individuelle Beschwerden und weitere gesundheitliche Faktoren
- mögliche Belastungen und Gewohnheiten im Alltag
- das Therapieziel
Rundgestrickte Kompressionsstrümpfe werden nahtlos gefertigt und zeichnen sich durch ihre Elastizität und dünnere Materialstärke aus. Sie eignen sich vor allem für Patienten mit geringeren Umfangsdifferenzen und ohne ausgeprägte Verformungen der Extremitäten. Flachgestrickte Kompressionsstrümpfe werden aus weniger elastischem Material gefertigt und haben eine Naht. Sie bieten einen höheren Arbeitsdruck und sind ideal für Patienten mit Lymphödemen, da sie sich besser an ungleichmäßige Körperformen anpassen lassen [26, 27].
Bei ausgeprägten Formveränderungen oder zur Erleichterung des An- und Ausziehens können Strümpfe geteilt werden. Dies erleichtert die Handhabung und erhöht die Compliance des Patienten. Eine Zehenkappe oder ein geschlossener Zehenbereich ist wichtig, um auch die Zehen und den Vorfußbereich in die Kompressionstherapie einzubeziehen, besonders bei distalen Ödemen. Maßanfertigungen sind oft notwendig, um eine optimale Passform und Wirksamkeit zu gewährleisten. Dies ist besonders bei flachgestrickten Strümpfen der Fall.
Lymphsets sind kombinierte Versorgungen, die aus mehreren Komponenten bestehen, wie z. B. Kompressionsbandagen. Sie bestehen aus Kurzzugbinden und Polstermaterialien, um den Arbeitsdruck zu erhöhen und Unebenheiten auszugleichen.
Die Verordnung muss die genaue Diagnose nach ICD-10 enthalten. Zum Hilfsmittel: Es sollten detaillierte Angaben gemacht werden, einschließlich Strickart (Rundstrick oder Flachstrick), Kompressionsklasse (KKL I-IV), Ausstattungsmerkmale (geteilte Versorgung, Zehenkappe, Haftband), Maßanfertigung oder Seriengröße (Abb. 4).

Abb. 4: Muster eines Rezepts zur Verordnung von MKS
Bei mittelgradiger Beanspruchung der medizinischen Kompressionsstrümpfe / -versorgungen soll ein wirksamer Kompressionsdruck für die Dauer von etwa 6 Monaten gewährleistet sein. In Einzelfällen kann eine Doppelversorgung – zwei Kompressionsstrümpfe übereinander – erforderlich sein. Bei Patienten mit starker körperlicher Belastung, wie auch bei krankheitsbedingter Formänderung des Lymphödems, kann eine neue Verordnung der medizinischen Kompressionsstrümpfe bereits früher erforderlich werden. Aus hygienischen Gründen ist eine Wechselversorgung notwendig [2]. Im Stadium II und III ist die Kompressionstherapie auf Dauer indiziert.
Eine Arbeit aus dem Jahr 2022 untersuchte die Versorgung mit medizinischen Kompressionsstrümpfen (MKS) aus Patientensicht [28]. 8 % der deutschen Bevölkerung tragen vom Arzt verordnete MKS, Frauen häufiger als Männer (12 % vs. 5 %) und insbesondere Personen ab 60 Jahren (17 %). Venenprobleme sind der häufigste Verordnungsgrund (44 %), gefolgt von Lymphödemen (22 %) bzw. Mehrfachindikationen (27 %).
Die Studie untersuchte die Versorgungsqualität durch strukturierte Interviews mit mehr als 400 repräsentativ ausgewählten Nutzern. Patienten tragen MKS demnach zumeist täglich und durchschnittlich 11 h/Tag; 89 % der Patienten waren zufrieden bzw. sehr zufrieden mit den MKS und berichteten je nach Indikation ein differenziertes Wirkprofil. MKS werden von Patienten sehr gut akzeptiert und ein wichtiger Faktor für die Patientenadhärenz ist die ärztliche Schulung und Aufklärung. Bei der Verordnung sollten daher praktische Aspekte wie An- und Ausziehen, empfohlene Tragedauer und -häufigkeit sowie der Wirkmechanismus der MKS vermittelt werden.
Hautpflege
Durch die Ansammlung von Lymphflüssigkeit im Gewebe wird die Haut anfälliger für Trockenheit, Spannungsgefühle und Infektionen. Durch die gestörte Lymphzirkulation wird die Haut weniger gut mit Nährstoffen versorgt, was zu Trockenheit führt. Trockene Haut kann leichter einreißen, was Eintrittspforten für Bakterien bietet. Hautverletzungen können zu Infektionen wie Erysipel führen, die das Lymphödem verschlimmern können.
Eine sorgfältige Hautpflege kann solchen Komplikationen vorbeugen [13, 26, 29}.
Die Haut sollte täglich mit pH-neutralen und parfümfreien Reinigungsprodukten gewaschen werden, um den natürlichen Säureschutzmantel der Haut zu erhalten. Nach der Reinigung ist das Auftragen einer feuchtigkeitsspendenden Lotion oder Creme wichtig. Heißes Wasser, aggressive Seifen und übermäßiges Rubbeln sollten vermieden werden, um die Haut nicht zusätzlich zu reizen. Ferner sorgfältige Pflege der Finger- und Fußnägel, um Verletzungen zu vermeiden, die als Eintrittspforten für Infektionen dienen können sowie Verwendung von Sonnenschutzmitteln mit hohem Lichtschutzfaktor, um die Haut vor UV-Schäden zu schützen.
Unter Kompressionsverbänden und -strümpfen kann die Haut besonderen Belastungen ausgesetzt sein. Vor dem Anlegen von Kompressionsmaterialien sollte die Haut sauber und trocken sein. Feuchtigkeitscremes sollten gut eingezogen sein, um ein Verrutschen der Bandagen zu verhindern. Die Verwendung von Unterziehstrümpfen oder Polstermaterialien aus atmungsaktiven Stoffen kann Feuchtigkeitsstau und Hautreizungen vorbeugen. Die Haut unter den Kompressionsmaterialien sollte regelmäßig auf Druckstellen, Rötungen oder Anzeichen von Infektionen überprüft werden.
Entstauungsübungen und Selbstbehandlung
Regelmäßige körperliche Aktivität und spezifische Bewegungsübungen unterstützen die Muskelpumpe und fördern den Lymphabfluss [30]. Sie sollen daher in das therapeutische Gesamtkonzept einbezogen werden . Die Selbstbehandlung durch den Patienten spielt dabei eine wichtige Rolle, um den Therapieerfolg langfristig zu sichern.
Zu den empfohlenen Übungsformen gehören aerobe Aktivitäten (z. B. moderate Ausdaueraktivitäten wie Gehen, Schwimmen oder Radfahren) sowie speziell entwickelte Übungen, die auf das Lymphödem abgestimmt sind (z. B. Bewegungsabfolgen für die betroffenen Bereiche). Tiefes Atmen kann den Lymphfluss im thorakalen Ductus stimulieren und so den Abtransport von Lymphe unterstützen [31]. Nach Anleitung durch Fachpersonal können Patienten einfache Drainagetechniken selbst durchführen.
Medikamentöse und chirurgische Interventionen
Der Einsatz von Medikamenten beim Lymphödem ist begrenzt. Diuretika sind in der Regel nicht wirksam, da sie hauptsächlich Wasser aus dem Gefäßsystem entfernen und nicht das proteinreiche Ödem beeinflussen [32]. Phlebotonika wie Flavonoide wurden untersucht, jedoch ist die Evidenz für ihre Wirksamkeit schwach. Entzündungshemmende Medikamente können bei akut entzündlichen Prozessen hilfreich sein. Antibiotika sind bei bakteriellen Infektionen wie Erysipel indiziert [26].
Bei Patienten, die nicht auf konservative Therapien ansprechen, können chirurgische Verfahren in Betracht gezogen werden. Nach Leitlinie [2] kommt eine operative Therapie infrage, wenn ein Patient trotz leitliniengerechter konservativer Therapie und Therapieadhärenz einen hohen Leidensdruck oder eine Zunahme von sekundären Gewebeveränderungen aufweist.
Neben rekonstruktive mikrochirurgische Verfahren (z. B. lymphovenöse Anastomosen oder vaskularisierte Lymphknotentransplantation) [33] wird die Liposuktion bei Lymphödemen mit ausgeprägter Fettgewebsvermehrung eingesetzt [12, 34]. Sie entfernt überschüssiges Fettgewebe und kann das Volumen der Extremität deutlich reduzieren. Eine konsequente postoperative Kompressionstherapie ist notwendig, um das Ergebnis zu erhalten. Neue Ansätze wie Low-Level-Lasertherapie [35] oder Kinesio-Taping [36] werden teilweise ergänzend zur Kompressionstherapie eingesetzt. Es gibt aber noch keine ausreichende Evidenz für ihren Einsatz.
Aktuelle pharmakologische Forschungsansätze untersuchen u. a. die Anwendung von Wachstumsfaktoren und molekularen Therapien, um die Lymphangiogenese zu fördern. Diese Therapien befinden sich jedoch noch in frühen Entwicklungsstadien.
Management und Nachsorge
Ein effektives Management und eine sorgfältige Nachsorge sind essenziell, um die Progression des Lymphödems zu verhindern, Komplikationen zu minimieren und die Lebensqualität der Patienten zu verbessern. Da das Lymphödem eine chronische Erkrankung ist, erfordert es eine lebenslange Betreuung und Selbstmanagement [22, 37]. Dabei besteht das Ziel der Rehabilitation in einer Verbesserung bzw. Wiederherstellung der Partizipation der Patienten am privaten, beruflichen und gesellschaftlichen Leben im jeweiligen kulturellen und sozialen Kontext. Die eingetretene Störung muss von jedem Patienten in erster Linie „bewältigt“ werden [38] (Abb. 5).
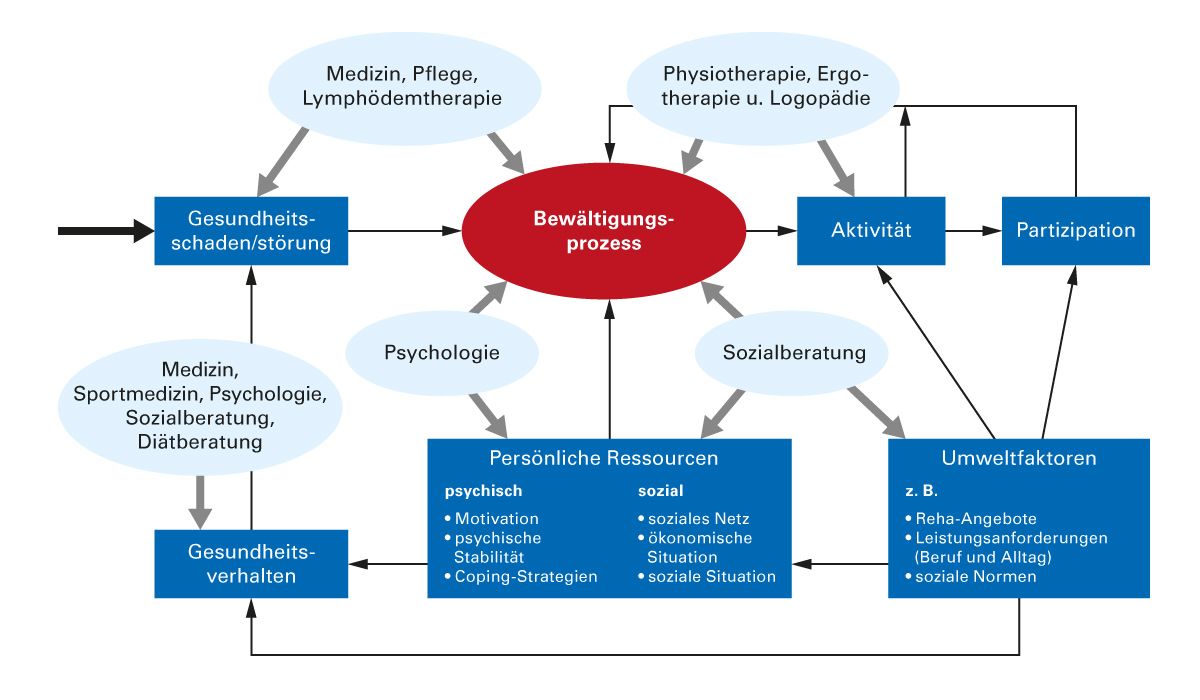
Abb. 5: Theoriemodell der Rehabilitation [adaptiert nach 38]
Moderne Technologien können das Management des Lymphödems dabei unterstützen. Apps und digitale Tagebücher helfen bei der Dokumentation von Symptomen und fördern die Therapieadhärenz und Telemedizin ermöglicht die Fernüberwachung und Beratung durch Fachkräfte [40, 41]. Eine enge Kooperation zwischen Hausärzten, Fachärzten und Therapeuten ist für eine ganzheitliche Versorgung unerlässlich.
Fazit
Das Lymphödem ist eine chronische Erkrankung, die durch eine gestörte Lymphdrainage zu einer Ansammlung von Lymphflüssigkeit und damit zu anhaltenden Schwellungen führt. Es gibt primäre und sekundäre Formen, wobei letztere meist durch erworbene Schäden am lymphatischen System entstehen, häufig nach onkologischen Eingriffen. Das klinische Bild umfasst Schwellungen, die sich im Verlauf verhärten können, sowie Hautveränderungen und das Risiko von Komplikationen wie Infektionen.
Die Diagnostik basiert auf einer gründlichen Anamnese, körperlicher Untersuchung und dem Einsatz bildgebender Verfahren. In der Therapie hat sich die Komplexe Physikalische Entstauungstherapie als Goldstandard etabliert, bestehend aus manueller Lymphdrainage, Kompressionstherapie, Hautpflege, entstauungsfördender Sport-/ Bewegungstherapie sowie Aufklärung und Schulung zur individuellen Selbsttherapie. Bei fortgeschrittenen Fällen können chirurgische Maßnahmen erwogen werden. Das Lymphödem erfordert ein lebenslanges Selbstmanagement, um die Progression der Erkrankung zu verhindern und die Lebensqualität zu erhalten.
Literatur
- Rockson SG (2001) Lymphedema. Am J Med 110: 288-295
- S2k-Leitlinie Diagnostik und Therapie der Lymphödeme 2017; AWMF Reg.-Nr. 058-001
- DiSipio T et al (2013) Incidence of unilateral arm lymphoedema after breast cancer: a systematic review and metaanalysis. Lancet Oncol 14: 500-515
- Damstra RJ et al (2017) The Dutch lymphedema guidelines based on the international classification of functioning, disability, and health and the chronic care model. J Vasc Surg Venous Lymphat Disord 2017; 5: 756-765
- Olszewski WL (2003) Pathophysiology of lymphedema. Lymphat Res Biol 1: 5-14
- Mortimer PS et al (2014) New developments in clinical aspects of lymphatic disease. J Clin Invest 124: 915-921
- Faerber G (2023) Adipositas und sekundäres Lymphödem. Dermatologie 74: 588-593
- Nuwayhid R et al (2024) Kostenvergleich der konservativen vs. operativen Therapie des chronischen Lymphödems. Chirurgie. DOI: https://doi.org/10.1007/s00104-024-02123-9
- Grada AA et al (2017) Lymphedema: Pathophysiology and clinical manifestations. J Am Acad Dermatol 77: 1009-1020
- Lee SO et al (2024) Molecular pathophysiology of secondary lymphedema. Front Cell Dev Biol 12: 1363811
- Faerber G (2018) Adipositas und Inflammation bei phlebologischen und lymphologischen Erkrankungen. Phlebologie 47: 55-65
- Zuther JE (2013) Lymphedema Management: The Comprehensive Guide for Practitioners. 3rd ed. Thieme
- International Society of Lymphology (2016) The diagnosis and treatment of peripheral lymphedema: 2016 consensus document. Lymphology 49: 170-184
- Stemmer R (1976) Ein klinisches Zeichen zur Früh- und Differenzialdiagnose des Lymphödems. VASA 5: 261-262
- Gültig O et al (2016) Leitfaden Lymphologie. Urban und Fischer, S. 43
- Partsch H et al (2010) Comparison of three portable instruments to measure compression pressure. Int Angiol 29: 426-430
- Naouri M et al (2010) High-resolution cutaneous ultrasonography to differentiate lipoedema from lymphoedema. Br J Dermatol 163: 296-301
- Dayan JH et al (2020) Regional patterns of fluid and fat accumulation in patients with lower extremity lymphedema using magnetic resonance angiography. Plast Reconstr Surg 145: 555-563
- Shavit A et al (2018) Lipoedema is not lymphoedema: A review of current literature. Int Wound J 15: 921-928
- Eberhardt RT et al (2014) Chronic venous insufficiency. Circulation 130: 333-346
- S2k-Leitlinie Lipödem (2024): AWMF-Registernummer 037-012 Version 5.0 vom 22.1.2024
- International Society of Lymphology (2020). The diagnosis and treatment of peripheral lymphedema: 2020 consensus document. Lymphology 53: 3-19
- Tzani I et al (2018) Physiotherapeutic rehabilitation of lymphedema: state-of-the-art. Lymphology 51: 1-12
- Gemeinsamer Bundesausschuss (G-BA). Heilmittel-Richtlinie 2024. Verfügbar unter: https://www.g-ba.de/downloads/62-492-3616/HeilM-RL_2024-04-18_2024-05-16_iK-2024-10-01.pdf
- Partsch H (2012) Compression therapy: clinical and experimental evidence. Ann Vasc Dis 5: 416-422
- International Lymphoedema Framework (2006) Best Practice for the Management of Lymphoedema. Verfügbar unter: https://www.lympho.org/uploads/files/files/Best_practice.pdf
- O’Donnell TF et al (2020) A systematic review of guidelines for lymphedema and the need for contemporary intersocietal guidelines for the management of lymphedema. J Vasc Surg Venous Lymphat Disord 8: 676-684
- Stücker M et al (2022) Medizinische Kompressionsstrümpfe bei chronischen venösen Erkrankungen und Lymphödem. Hautarzt 73: 708-717
- Jones A et al (2019) Critical examination of skin care self-management in lymphoedema. Br J Community Nurs 24(Sup10): S6-S10
- McNeely ML et al (2010) Exercise interventions for upper-limb dysfunction due to breast cancer treatment. Cochrane Database Syst Rev 6: CD005211
- Cormier JN et al (2010) Lymphedema beyond breast cancer: a systematic review and meta-analysis of cancer-related secondary lymphedema. Cancer 116: 5138-5149
- Brown S et al (2022) Pharmacological Treatment of Secondary Lymphedema. Front Pharmacol 13: 828513
- Campisi C et al (2004) Microsurgical techniques for lymphedema treatment: derivative lymphatic-venous microsurgery. World J Surg 28: 609-613
- Brorson H (2016) Liposuction in lymphedema treatment. J Reconstr Microsurg 32: 56-65
- Smoot B et al (2015) Effect of low-level laser therapy on pain and swelling in women with breast cancer-related lymphedema: a systematic review and meta-analysis. J Cancer Surviv 9: 287-304
- Blanco EG et al (2020) Efficacy of Kinesio® taping in the Treatment of lymphoedema after breast cancer: a systematic review. Journal of Lymphoedema 15: 71-76
- Moffatt CJ et al (2019) The concept of chronic edema – a neglected public health issue and an international response: the LIMPRINT study. Lymphat Res Biol 17: 121-126
- Gerdes N et al (2000) Zur Theorie der Rehabilitation. In: Bengel J, Koch U (Eds) Grundlagen der Rehabilitationswissenschaften: Themen, Strategien und Methoden der Rehabilitationsforschung. Springer 41-68
- Bodenheimer T et al (2002). Patient self-management of chronic disease in primary care JAMA 288: 2469-2475
- Fu MR et al (2016) mHealth self-care interventions: managing symptoms following breast cancer treatment. mHealth 2: 28
- Havens LM et al (2021) Use of technology to facilitate a prospective surveillance program for breast cancer-related lymphedema at the Massachusetts General Hospital. mHealth 7: 11
Bildquellen
Titelbild: © Pepermpron – stock.adobe.com
Abb. 2: © Pepermpron – stock.adobe.com
Abb. 3: © Blue – stock.adobe.com

Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der arztCME-Online-Akademie erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.