Osteoporose – wesentliche Aspekte der Diagnostik und Therapie unter Berücksichtigung der aktualisierten S3-Leitlinie 2023
Interessengebiete: Allgemeinmedizin und Innere Medizin, Orthopädie, Geriatrie, Rheumatologie
Osteoporose zählt zu den zehn weltweit am häufigsten auftretenden Erkrankungen. Die enorme volkswirtschaftliche Bedeutung von Osteoporose und der hohe Einfluss auf die Lebensqualität der Betroffenen erfordern bei allen Menschen mit einem erhöhten Osteoporoserisiko Basismaßnahmen zur Prävention wie auch adjuvant zur Therapie. Nach einer ausführlichen Diagnose sollen, zur Verbesserung der Therapieadhärenz, individuelle Lösungen gesucht werden. Dabei können auch orthopädische Hilfsmittel eine wichtige Rolle bei der Verbesserung der Lebensqualität und Unabhängigkeit der Betroffenen spielen.
Die vorliegende CME beschreibt die wichtigsten pathophysiologischen Ursachen und fasst die wesentlichen Aspekte zur Diagnostik und Therapie der Osteoporose zusammen. Dabei fokussiert die Fortbildung auf die aktuelle Leitlinie zur Diagnostik und Therapie der Osteoporose 2023 des Dachverband Osteologie e. V. (DVO).
Kursinhalt
Inhaltsverzeichnis
Vorwort
Osteoporose hat eine enorme volkswirtschaftliche Bedeutung und einen hohen Einfluss auf die Lebensqualität der betroffenen Patienten. Die vorliegende CME beschreibt die wichtigsten pathophysiologischen Ursachen und fasst die wesentlichen Aspekte zur Diagnostik und Therapie der Osteoporose zusammen. Dabei fokussiert die Fortbildung auf die aktuelle Leitlinie zur Diagnostik und Therapie der Osteoporose 2023 des Dachverbandes Osteologie e. V. (DVO).
Einleitung
Die Osteoporose ist gekennzeichnet durch eine abnehmende Knochenmasse und eine Verschlechterung der Knochenmikroarchitektur. Die daraus resultierende verminderte Knochenstabilität bedingt eine erhöhte Frakturneigung [1, 2]. Die World Health Organization (WHO) zählt Osteoporose bereits seit 1994 zu den zehn bedeutsamsten und weltweit am häufigsten auftretenden Erkrankungen [3]. In Deutschland geht man von 6-8 Millionen Betroffenen aus [4].
Die Osteoporose wird traditionell in verschiedene Formen unterteilt: Bei der primären oder „idiopathischen“ Osteoporose sind keine einzelnen kausal auslösenden Faktoren zu identifizieren. Sie wird multikausal mitverursacht z. B. durch altersbedingte Veränderungen, regulatorische oder hormonelle Faktoren, genetische Einflüsse, Lebensweisen, etc. Bei der sekundären Osteoporose lassen sich führend bestimmte ursächlich auslösende Faktoren, Erkrankungen oder Medikamente identifizieren. Diese Unterteilung tritt in der Praxis aber zunehmend in den Hintergrund, da Osteoporose meist multifaktoriell bedingt ist, und daher eine umfassende Berücksichtigung und Bewertung aller auslösenden Osteoporoserisiken Pflicht ist und auch die Diagnostik und Therapie immer hiervon abhängen.
Klinisch relevant ist die Unterteilung der Osteoporose in eine präklinische Stufe, die noch nicht klinisch in Erscheinung getreten ist, also noch keine Frakturen verursacht hat. Die WHO klassifiziert sie mit dem ICD10-GM-Code M81.x. Diese Stufe der Osteoporose ist demnach ein therapiebedürftig hohes Risiko für eine Fragilitätsfraktur, vergleichbar mit einen klinisch stummen Hypertonus, der lediglich ein therapiebedürftiges Risiko für kardiovaskuläre Events darstellt.
Bei der manifesten Osteoporose (ICD10-GM-Code M80.x) ist es bereits zur Fragilitätsfraktur gekommen, daher „klinisch manifest“.
Ziel der Osteoporosediagnostik ist es, aufgrund einer Risikostratifizierung Menschen zu identifizieren, die ein erhöhtes Risiko für osteoporotische Frakturen haben und sie gegebenenfalls einer Verlaufskontrolle oder einer Therapie zuzuführen. Ziel der Osteoporosetherapie ist es, erstmalige oder erneute Frakturen zu verhindern.
Das Risiko, an Osteoporose zu erkranken, steigt mit dem Alter. Durch den in der Menopause sinkenden Östrogenspiegel ist es für Frauen wesentlich höher als für Männer. Östrogen spielt eine wichtige Rolle bei der Regulation des Knochenstoffwechsels [5].
Zu den Komorbiditäten, die zu sekundärer Osteoporose führen oder eine idiopathische Osteoporose verstärken können, gehören [6-8]:
- Endokrine Störungen: Hyperparathyreoidismus, Hyperthyreose, Hypogonadismus, Cushing-Syndrom und Diabetes mellitus Typ 1 und 2
- Gastrointestinale Erkrankungen wie Zöliakie und CED (chronisch entzündliche Darmerkrankungen)
- Rheumatische Erkrankungen, hier vor allem SLE (systemischer Lupus erythematodes) und RA (rheumatoide Arthritis)
- Hämatoonkologische Erkrankungen wie das Multiple Myelom
- Nierenerkrankungen, die zu einer chronischen Niereninsuffizienz führen
Von den Medikamenten, die das Risiko einer Osteoporose erhöhen, sind die am häufigsten verordneten [9-12]:
- Glukokortikoide
- Antikoagulantien
- Aromatasehemmer
- Protonenpumpenhemmer
Epidemiologie
Weltweit wird geschätzt, dass etwa 200 Millionen Menschen von Osteoporose betroffen sind [13]. Das Risiko steigt mit dem Alter, wobei Frauen ein höheres Risiko haben als Männer [14]. Die hormonellen Veränderungen während der Menopause können zu einem beschleunigten Knochenabbau führen. Weitere Risikofaktoren für die Entwicklung von Osteoporose sind genetische Faktoren, ethnische Zugehörigkeit, Körpergewicht, Ernährung, Bewegungsmangel, Rauchen und Alkoholkonsum [15]. Genetische Faktoren spielen eine wichtige Rolle bei der Entstehung von Osteoporose, wobei etwa 60-80 % der Knochenmineraldichte (BMD) erblich determiniert sind. Es wurden mehrere Gene identifiziert, die mit einem erhöhten Osteoporoserisiko in Verbindung gebracht werden, darunter solche, die an der Knochenbildung und dem Knochenabbau beteiligt sind [16]. Ethnische Unterschiede in der Prävalenz von Osteoporose können auf Unterschiede in genetischen Faktoren, Ernährung, Sonnenlichtexposition und Lebensstil zurückgeführt werden. Ein niedriges Körpergewicht ist ein bekannter Risikofaktor für Osteoporose, da es mit einer geringeren Knochenmasse assoziiert ist [1].
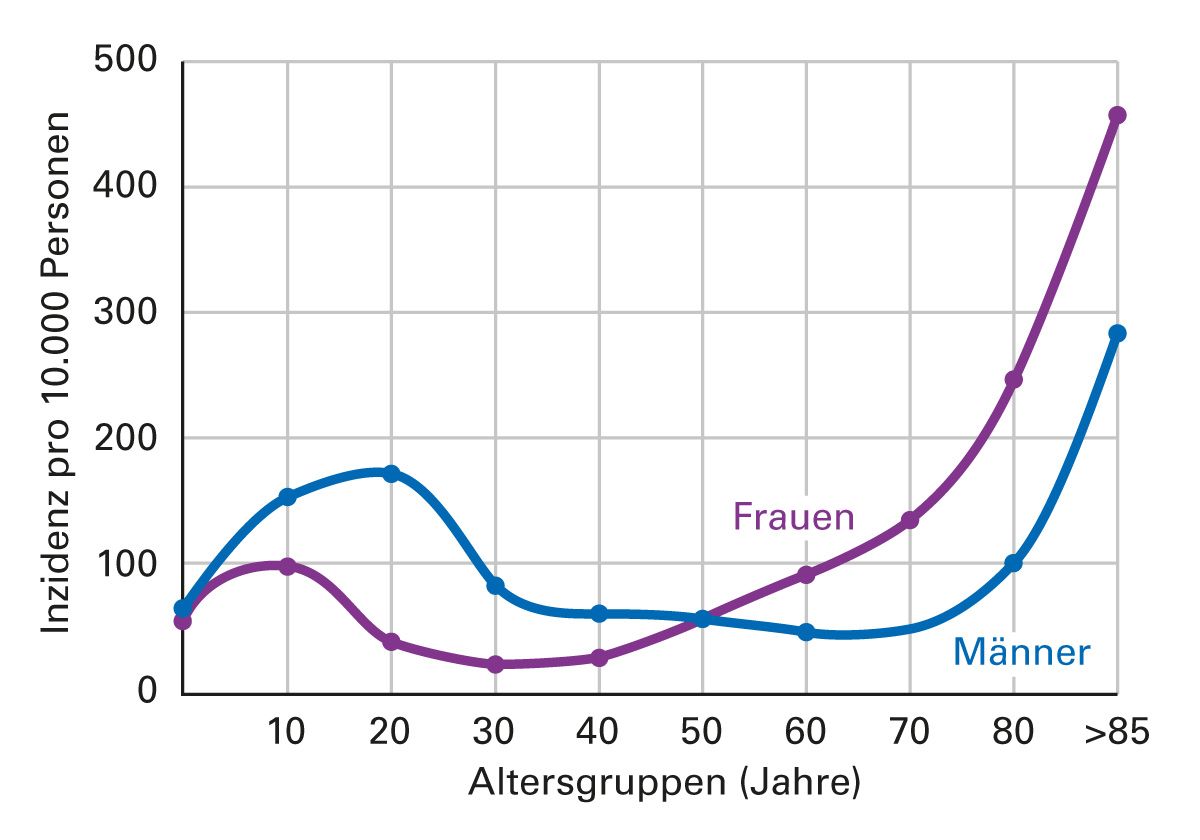
Die Osteoporose führte 2019 in Deutschland zu 688.000 registrierten Frakturen, davon ca. 67.000 Wirbelkörper- und 230.000 Oberschenkelfrakturen. Die tatsächlichen Frakturzahlen (vor allem die Wirbelfrakturen) dürften aber wesentlich höher liegen. So sind auf die Frakturen jährlich mehr Krankenhaustage zurückzuführen als beispielsweise auf Diabetes mellitus, Herzinfarkt und Brustkrebs zusammen. Bei Männern gibt es einen Häufigkeitsgipfel mit ca. 20 Jahren und bei Frauen ein deutlich früheres Auftreten der Frakturen im Alter [17] (Abb. 1).
Physiologie des Knochens
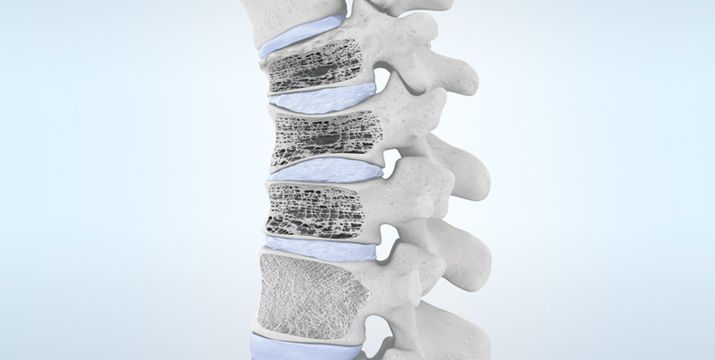
Um die Pathophysiologie der Osteoporose zu verstehen, ist es wichtig, die Struktur des Knochens und die Mechanismen der Knochenhomöostase zu kennen. Knochen besteht aus einer organischen Matrix, Mineralien und Wasser. Die organische Matrix besteht hauptsächlich aus Kollagenfasern und Proteoglykanen, die für die Zugfestigkeit und Flexibilität des Knochens verantwortlich sind. Die Mineralien, hauptsächlich Hydroxylapatitkristalle, sind in die organische Matrix eingelagert und verleihen dem Knochen seine Härte und Druckfestigkeit [17] (Abb. 2).
Knochen werden in zwei Haupttypen unterteilt: kortikale oder kompakte Knochen und trabekuläre oder spongiöse Knochen. Kortikale Knochen machen etwa 80 % des Skeletts aus und bilden die dichte äußere Schicht, die für die mechanische Festigkeit und die Schutzfunktion des Knochens verantwortlich ist. Trabekuläre Knochen machen etwa 20 % des Skeletts aus und bestehen aus einer netzartigen Struktur von Knochenbälkchen, die die inneren Knochenhohlräume ausfüllen. Trabekuläre Knochen haben eine größere Oberfläche als kortikale Knochen und sind daher stärker am Stoffwechsel und am Knochenumbau beteiligt.
Es gibt drei Haupttypen von Knochenzellen [17]:
- Osteoblasten sind für die Synthese und Mineralisierung der Knochenmatrix verantwortlich. Sie sezernieren Kollagen Typ I sowie verschiedene nicht-kollagene Proteine, darunter Osteocalcin und Osteopontin.
- Osteozyten entstehen aus in den Knochen eingebauten Osteoblasten und machen den Großteil aller Knochenzellen aus. Sie sind für die mechanische Belastung des Knochens und die Regulation des Knochenumbaus verantwortlich. Osteozyten kommunizieren durch Kanälchen im Knochen miteinander und übertragen Signale (z. B. Sclerostin) zur Regulation von Osteoblasten und Osteoklasten. Osteozyten kontrollieren die aktuellen Belastungsanforderungen an den Knochen und passen den Knochenumbau hieran an.
- Osteoklasten sind als mehrkernige Riesenzellen für den Knochenabbau verantwortlich. Sie sind in der Lage, Knochenmatrix zu resorbieren. Ihre Aktivität wird durch verschiedene Faktoren, wie z. B. Parathormon (PTH), Kalzitonin und Rezeptoraktivator für den Nuklearfaktor κB Ligand (RANKL) reguliert.
Knochenzellen vermögen über verschiedene Mediatoren miteinander zu kommunizieren. Die Knochenremodellierung ist ein kontinuierlicher Prozess, bei dem alte Knochenmatrix abgebaut und durch neue ersetzt wird. Sie besteht aus drei aktiven Hauptphasen [17]:
- Resorptionsphase: Osteoklasten binden an die Knochenoberfläche und bilden eine abgedichtete Kammer, in der sie mineralischen Knochenanteil und Knochenmatrix durch die Ausschüttung von sauren Proteasen und Hydrolyse-Enzymen abbauen, um die Erneuerung des Knochens zu ermöglichen.
- Reversalphase: Osteoklasten werden durch Osteoblasten ersetzt, Monozyten und Makrophagen wandern zur Knochenoberfläche, um Knochenmatrixfragmente und abgestorbene Osteoklasten zu entfernen.
- Formationsphase: Osteoblasten synthetisieren neue Knochenmatrix und mineralisieren sie.
Danach kommt die Ruhephase. Diese Phasen laufen jederzeit parallel im Knochen ab.
Pathophysiologie der Osteoporose
Die Pathophysiologie der Osteoporose ist gekennzeichnet durch eine Imbalance zwischen Knochenresorption und Knochenformation, wodurch die Knochenmasse abnimmt und die Knochenmikroarchitektur verschlechtert wird. Zu den bekannten Risikofaktoren gehören Alter, Hormonmangel, genetische Faktoren, Ernährung, Bewegungsmangel und Umweltfaktoren [17] und viele andere mehr.
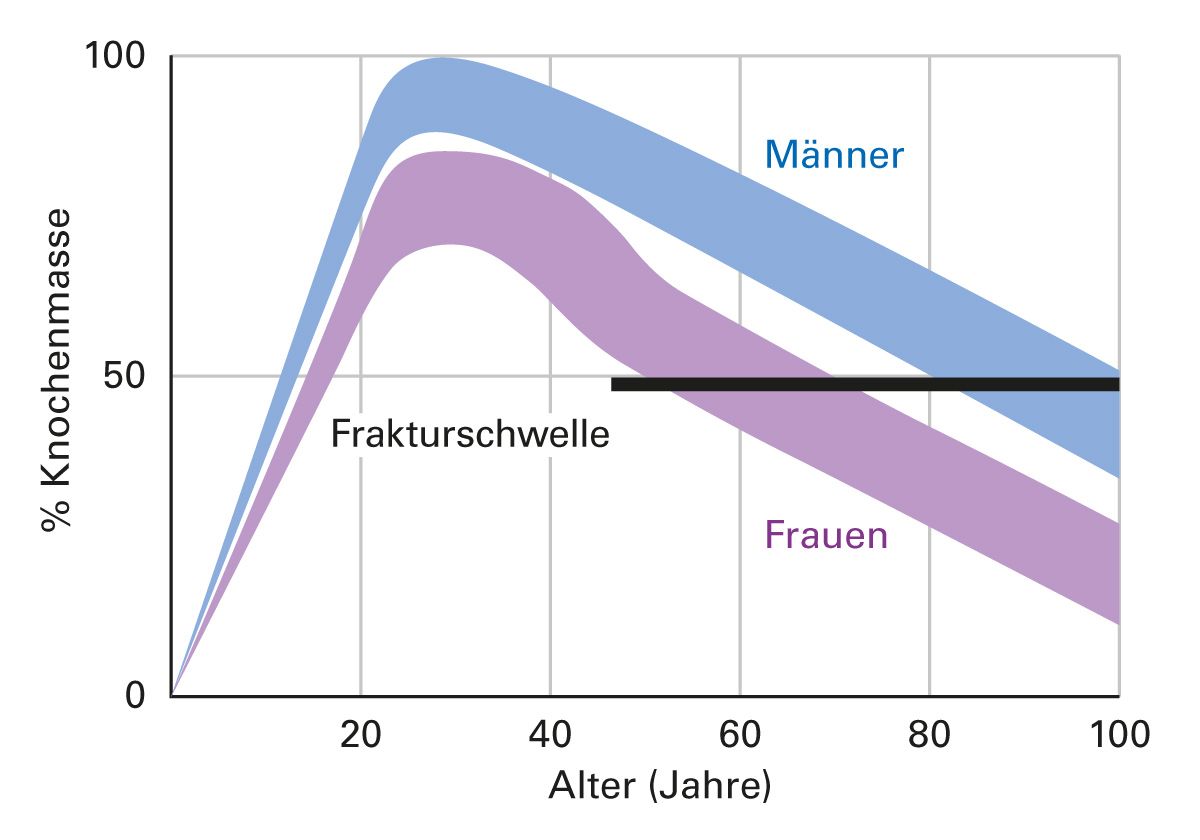
Mit zunehmendem Alter kommt es auch unabhängig von anderen Einflussfaktoren zu einer Abnahme der Knochenmasse, da die Knochenresorption die Knochenformation übersteigt (Abb. 3). Dies ist zum Teil auf eine verminderte Funktion von Osteoblasten und eine erhöhte Aktivität von Osteoklasten zurückzuführen.
Hormonelle Veränderungen, insbesondere der Rückgang der Östrogenspiegel bei Frauen nach der Menopause, tragen ebenfalls zur Entwicklung von Osteoporose bei, da Östrogene die Knochenresorption hemmen und die Knochenformation fördern [18]. Bei
Männern ist ein Rückgang des Testosteronspiegels im Alter ebenfalls mit einer erhöhten Knochenresorption und einer verminderten Knochenmasse verbunden [19], der aber nicht so steil verläuft wie bei der Frau. Daher haben Frauen in etwa doppelt so häufig Osteoporose wie Männer.
Genetische Faktoren beeinflussen die individuelle Anfälligkeit für Osteoporose, wobei etwa 60-80 % der Knochenmineraldichte (BMD) erblich bedingt sind. Mehrere Gene, die an der Knochenbildung und dem Knochenabbau beteiligt sind, wurden identifiziert, wie zum Beispiel solche, die mit dem Vitamin D-Rezeptor, dem Kollagen Typ I und dem RANKL-System in Verbindung stehen [20].
Ernährungsfaktoren sind für die Knochengesundheit von entscheidender Bedeutung, da sie die Knochenmineralisierung und die Knochenumbauaktivität beeinflussen. Eine unzureichende Zufuhr von Kalzium und Vitamin D kann zu einer erhöhten Knochenresorption und einer verminderten Knochenmasse führen. Bewegungsmangel ist ein weiterer Risikofaktor für Osteoporose, da Bewegung die Knochenformation stimuliert und die Knochenmasse erhöht. Rauchen beeinträchtigt die Knochenformation und erhöht die Knochenresorption, während übermäßiger Alkoholkonsum die Kalziumabsorption und die Knochenbildung beeinträchtigt [1, 17].
Diagnostik der Osteoporose
Die Diagnostik bei der Osteoporose basiert auf einer Evaluation von klinischen Risikofaktoren, der klinischen Untersuchung und der Beurteilung der Knochenmineraldichte (BMD) sowie Laboruntersuchungen. Hinzu kommt bei rechtfertigender Indikation die Röntgenbildgebung. Frühzeitige Diagnose und Intervention sind entscheidend, um das Frakturrisiko rasch zu reduzieren und die Lebensqualität der Patienten zu erhalten, da die Therapie relativ schnell wirkt.
Der diagnostische Ablauf gestaltet sich wie folgt:
- Der 1. wichtigste Schritt ist die Awareness, also die Idee, dass ein Patient / Mensch ein erhöhtes Risiko für eine Osteoporose haben könnte. Daran ist grundsätzlich bei allen Menschen über 50 Jahren zu denken sowie bei besonderen Risiken wie systemische Glukokortikoid-Therapie, Aromatase-Therapie, Anorexie, schweren sonstigen Erkrankungen und Transplantationen oder Niereninsuffizienz.
- Im 2. Schritt erfolgt mit Hilfe einer Risikoanamnese das „Case Finding“, also die Identifikation der Patienten, die einer „Basisdiagnostik“ gemäß der Leitlinie bedürfen. Hierzu trifft der Arzt aufgrund einer standardisierten Risikoerfassung und seiner persönlichen ärztlichen Einschätzung die Entscheidung [1].
- Im entsprechenden Fall erfolgt dann die Basisdiagnostik bestehend aus umfassender Anamnese, klinischem Befund, Basislabor, Knochendichtemessung nach der DXA-Methode und bei potenziell stattgehabter Fragilitätsfraktur eine native Röntgenbildgebung [1].
Anamnese – Case Finding
Die Leitlinie stellt fest: Der Arzt soll „bei Vorliegen einer ärztlich als relevant erachteten Risikokonstellation für Frakturen bei postmenopausalen Frauen und bei Männern ab dem Alter von 50 Jahren eine Basisdiagnostik empfehlen unter Beachtung des absoluten Frakturrisikos“ [1].
Hierzu werden in der Leitlinie folgende Risikofaktoren aufgeführt:
- Frakturen: Hüftfraktur, Wirbelfraktur, proximale Humerusfraktur, Beckenfraktur, distale Unterarmfraktur, ggf. auch sonstige Frakturen
- Endokrinologie Krankheiten: Diabetes mellitus Typ I und II, primärer Hyperparathyreoidismus, Cushing-Syndrom (incl. subklinisch), Wachstumshormonmangel, männlicher Hypogonadismus, TSH-Suppression
- Rheumatologische Erkrankungen: Rheumatoide Arthritis, Spondyloarthritiden, M. Crohn, Colitis ulcerosa, Syst. Lupus erythematodes
- Weitere Erkrankungen mit erhöhtem Frakturrisiko: COPD, Herzinsuffizienz, Niereninsuffizienz > CKD 3a, MGUS, HIV, Z. n. bariatrischer Operation, Billroth-II-OP, Gastrektomie, Hyponatriämie
- Neurologische und psychiatrische Erkrankungen: Schlaganfall, Multiple Sklerose, Morbus Parkinson, Demenz, Depression, Immobilität (Angewiesensein auf eine Gehhilfe), Sturzneigung (> 1 Sturz in 12 Monaten)
- Hüftfrakturanamnese der Eltern ab dem 75. Lebensjahr
- Medikamente mit Einfluss auf den Knochen oder Erhöhung des Sturzrisikos, insbesondere PPI, Opioide, Antidepressiva, in besonderer Weise Glukokortikoide, Aromatase-Inhibition und Antitestosterontherapie
- Gefährdende Lebensführung: Untergewicht mit einem BMI < 20 kg/m2, Rauchen >10 Zigaretten/Tag, Alkoholkonsum
- Ein Alter über 70 Jahre stellt per se eine Indikation zur Basisdiagnostik dar.
Bei besonderen Risiken besteht auch bei Menschen unter 50 Jahren eine Indikation zur Basisdiagnostik. Als Beispiele seien erwähnt: Aromatase-Inhibition, Anorexie, Therapie mit Glukokortikoiden, Niereninsuffizienz, Transplantationen, HPT, eine Kumulation relevanter Risikofaktoren.
Neben der Anamnese ist selbstverständlich auch die klinische Untersuchung obligat, um Hinweise auf stattgehabte Frakturen oder Befunde für mögliche sekundäre Osteoporoserisiken zu erkennen.
Bildgebende Verfahren
Die „Dual x-ray absorptiometry“ (DXA) ist Bestandteil der „Basistherapie“ und der „Goldstandard“ zur Messung der Knochenmineraldichte (BMD). Mit ihrer Hilfe kann im Kontext mit der Anamnese frühzeitig ein hohes Risiko für osteoporotische Frakturen erkannt werden, auch bevor bereits Frakturen aufgetreten sind.
Eine erhöhte Riskokonstellation im Case Finding stellt eine rechtfertigende Indikation für eine Knochendichtemessung mittels Dualer Röntgen-Absorptiometrie (DXA) dar. Gemessen wird an definierten Lokalisationen: an der Lendenwirbelsäule (LWS) an den Wirbelkörpern L1 bis L4 (mindestens Berücksichtigung von zwei Wirbeln, Bildung eines Mittelwertes) sowie am proximalen Femur (Neck- und Totalareal) beidseits. Die DXA-Methode basiert auf der Absorption von zwei unterschiedlichen Röntgenenergien durch den Knochen [21], so dass Weichteile vom Knochen rechnerisch subtrahiert werden können. Die DXA-Messungen werden als T-Scores und Z-Scores ausgedrückt. Der T-Score vergleicht die BMD des Patienten mit dem Durchschnittswert einer gesunden jungen Erwachsenenpopulation desselben Geschlechts, während der Z-Score die BMD des Patienten mit dem Durchschnittswert einer alters-, geschlechts- und ethnisch entsprechenden Population vergleicht [1, 17]. Berücksichtigt wird grundsätzlich der T-Wert, nur bei jüngeren Menschen der Z-Wert.
Die WHO definierte bislang Osteoporose basierend auf dem T-Score: Ein T-Score von -1,0 oder höher wird als normal angesehen, ein T-Score zwischen -1,0 und -2,5 als Osteopenie (niedrige Knochenmasse), und ein T-Score von -2,5 oder niedriger als Osteoporose [3]. Diese Definition tritt in der heutigen Zeit in Anbetracht der vorrangigen Berechnung eines Risikos für osteoporotische Frakturen in der Praxis weltweit in den Hintergrund.
Der Trabecular Bone Score (TBS) ist ein zusätzliches bildgebend-rechnerisches Verfahren zur optionalen Ergänzung der Messung der DXA-Messung aus deren Datensatz, der insbesondere zur Untersuchung der trabekulären Knochenstruktur und zur Differenzierung zwischen kortikalem und trabekulärem Knochen dient.
Die quantitative Computertomographie (QCT), zentral und peripher, sowie Ultraschallverfahren wie die quantitative Ultraschallmessung (QUS), können ebenfalls zur Beurteilung der Knochenqualität und des Frakturrisikos eingesetzt werden. Hier ist allerdings darauf zu achten, dass die von den jeweiligen Herstellern angegebenen T-Werte niemals mit den DXA-T-Werten vergleichbar sind und daher niemals für die Verwendung der Leitlinien-Algorithmen dienen dürfen! In der Langversion der Leitlinie finden sich Anleitungen zur Umrechnung dieser ermittelten Werte in eine Risiko-Aussage [1].
Durch MRT oder Skelettröntgen können Art und Alter von Frakturen bestimmt werden [1, 17]. Der Grad der Wirbelkörperfraktur(en) gemäß der international anerkannten Einteilung nach Genant spielt für die Risikoabschätzung sowie die Therapieindikation eine wesentliche Rolle. Etwa ein Drittel aller Osteoporose-assoziierten Wirbelkörperfrakturen verlaufen okkult ohne klinische Symptome und werden erst in der Röntgendiagnostik entdeckt [22].
Laboruntersuchungen
Zusätzlich zu den bildgebenden Verfahren können Laboruntersuchungen dazu beitragen, das Frakturrisiko abzuschätzen und mögliche sekundäre Ursachen von Osteoporose zu identifizieren. Die Analyse des osteologischen Basislabors ist unerlässlich für den Ausschluss sekundärer Ursachen [1] sowie den Ausschluss von Kontraindikationen bestimmter Osteoporosemedikamente:
- Kalzium, Phosphat, Natrium aus dem Serum
- Kreatinin und gerechnete Kreatinin-Clearance (eGFR)
- Alkalische Phosphatase und Gamma-GT
- Blutbild, BSG, CRP, Eiweißelektrophorese
- TSH
- Ggf. 25-OH-Cholekalziferol und Parathormon
- Testosteron
Fakultative weitere Parameter bei besonderen Fragestellungen des spezialisierteren Osteologen sind
- Knochenumsatzmarker: Dies sind Substanzen, die im Blut oder im Urin nachgewiesen werden können und die Knochenresorption oder -formation reflektieren. Zu den Knochenresorptionsmarkern gehören C-terminales Telopeptid (CTX) und N-terminales Telopeptid (NTX), während Prokollagen Typ I N-Propeptid (PINP) und Osteocalcin zu den Knochenformationsmarkern zählen.
Eine mögliche Erweiterung bei entsprechendem klinischem Verdacht ist die Detektion möglicher seltener sekundärer Ursachen einer Osteoporose. Hierzu gehören [1]:
- Hypogonadismus
- Hyperparathyreoidismus
- Hyperthyreose
- monoklonale Gammopathien
- Mastozytose
Therapie der Osteoporose
Die Interventionen bei Osteopenie und Osteoporose zielen darauf ab, den Knochenabbau zu verlangsamen und neuen Knochen aufzubauen sowie Sturzrisiken zu minimieren. Hiermit soll das letztendliche „goldene Ziel“, die Verhinderung von Frakturen, erreicht werden!
Unabhängig von den allgemeinen Basismaßnahmen kann der Patient nur mit einer multimodalen und multidisziplinären Behandlung, bestehend aus einer Kombination aus Optimierung der Lebensführung, Medikamentenrevision, Vermeidung von Risikofaktoren, Muskelkräftigung, Sturzprophylaxe, Heilmitteln, Hilfsmitteln und Medikamenten, optimal versorgt werden (Abb. 4).
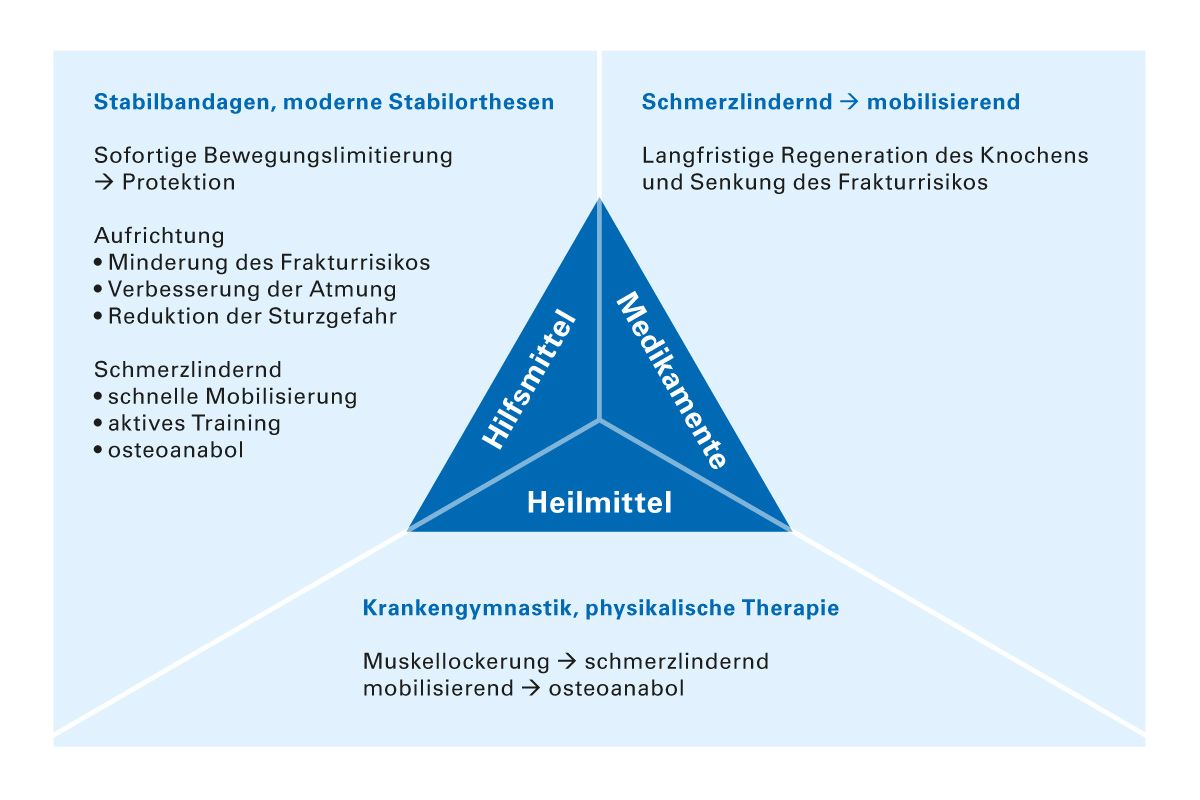
Abb. 4: Kombination von Heilmitteln, Hilfsmitteln und Medikamenten für die optimale Osteoporosetherapie
Basistherapie
Die Basistherapie der Osteoporose besteht aus drei Säulen:
- Förderung körperlicher Aktivität, Muskel- und Knochenaufbau sowie Sturzprophylaxe
- Optimierung der Ernährung und des Lebensstiles
- Medikamentenrevision zur Verminderung von Knochenschwächung und Sturzrisiken
Sie umfasst zum einen eine adäquate Zufuhr von Kalzium und eine Vitamin-D-Supplementation, zum anderen die Beeinflussung modifizierbarer Risikofaktoren und ein dem Muskelstatus angepasstes muskuläres Training mit dem Ziel, die muskuläre Funktion zu verbessern. Folgende Optionen stehen zur Verfügung [1]:
- Osteoporoserisikofaktoren, die modifizierbar sind, gehören angesprochen und wenn möglich geändert. Hierzu zählen Nikotinkonsum, Untergewicht mit einem Body Mass Index < 20 kg/m2 sowie modifizierbare Medikationen, die das Frakturrisiko erhöhen.
- Eine adäquate Kalziumzufuhr liegt dann vor, wenn täglich 1000 mg Kalzium, im besten Falle mit der Ernährung, aufgenommen werden. Nur wenn die Aufnahme durch die Ernährung nicht gewährleistet werden kann, ist ein Supplement zusätzlich empfohlen.
- Vitamin D kann im Alter < 70 Jahre in den Monaten April bis Oktober durch 20-30-minütige Sonnenexposition der Unterarme in ausreichender Menge i.d.R. „zugeführt“ werden. In den Monaten November bis März ist dies wegen des Sonnenstandes nicht möglich. Deswegen ist eine generelle Empfehlung in den Leitlinien zur Diagnostik und Therapie der Osteoporose, Vitamin D in den sonnenarmen Monaten täglich mit 800-1000 IE Cholecalciferol zu supplementieren. Ab dem Alter von 70 Jahren ist die durch Sonnenbestrahlung ausgelöste Synthese des Prävitamin D auch in den sonnenreichen Monaten aufgrund der veränderten Hautpigmentierung nicht mehr gewährleistet. Deswegen ist eine ganzjährige Substitution mit 1000 IE Cholecalciferol täglich ab 70 Jahren empfohlen.
- Muskeltraining ist essenziell zum Erhalt der Knochengesundheit. Dieses Muskeltraining sollte dem jeweiligen Funktionsstand der Muskulatur angepasst sein und wenn möglich im Verlauf an Intensität gesteigert werden. Zusätzlich ist ein Sturzpräventionstraining im höheren Alter empfohlen.
- Beratung und Training zur Senkung des Sturzrisikos
- Ggf. Tragen von Hüftprotektoren
- Ggf. Sekundärprophylaxe: Tragen von Orthesen zur Haltungskorrektur und Muskelaufbau
Schmerztherapie
Schmerzen sind ein häufiges und belastendes Symptom bei Osteoporose und können durch Knochenbrüche, Knochenverformungen, Muskelverspannungen oder Gelenkbelastungen verursacht werden (2). Unzureichend therapierte Schmerzen stellen einen bedeutsamen pathogenetischen Faktor für das Fortschreiten der Osteoporose dar (Abb. 5).
Schmerz führt zu Immobilisation, Rückzug und Inaktivität. Er stellt daher einen wesentlichen Protagonisten für den Knochenabbau dar.
Eine adäquate Schmerztherapie ist entscheidend für die Lebensqualität und die Funktionsfähigkeit von Patienten mit Osteoporose und sollte an die individuellen Bedürfnisse und den Schweregrad der Schmerzen des Patienten angepasst werden. Dabei wird oft eine multimodale Kombination aus medikamentösen und nicht-medikamentösen Therapieansätzen empfohlen [23].
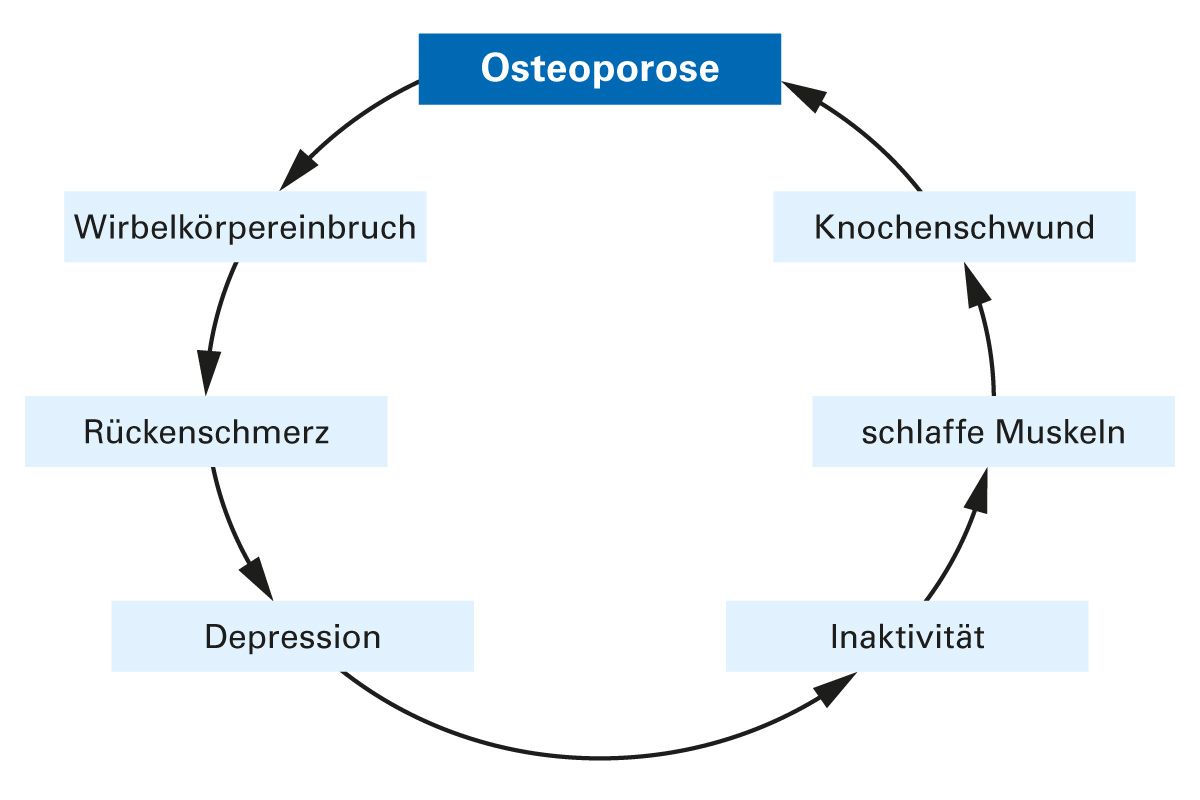
Abb. 5: Unzureichend therapierte Schmerzen stellen einen bedeutenden pathogenetischen Faktor für das Fortschreiten der Osteoporose dar [adaptiert nach 17].
Die medikamentöse Schmerztherapie bei Osteoporose umfasst verschiedene Arzneimittelklassen [1, 24, 25]:
- Nicht-steroidale Antirheumatika (NSAR) wie Ibuprofen, Diclofenac oder Naproxen sollten aufgrund gastroenterologischer und nephrologischer Nebenwirkungen nur kurzfristig und in der niedrigsten wirksamen Dosis eingesetzt werden. Bei älteren Menschen über 65 Jahre ist zwingend eine Protektion mit Protonenpumpenhemmern (PPI) erforderlich. Diese sind jedoch insbesondere in der Langzeiteinnahme knochenschädlich und erhöhen ihrerseits das Frakturrisiko.
- Paracetamol kann bei leichteren Schmerzen eingesetzt werden und hat weniger Nebenwirkungen als NSAR, ist allerdings dosisabhängig lebertoxisch. Die empfohlene Tagesdosis sollte nicht überschritten werden. Bei starken Schmerzen kann auch Novaminsulfon eingesetzt werden.
- Opioide wie Tramadol, Tilidin, Hydromorphon, Buprenorphin, Fentanyl oder Oxycodon sollten wegen des erhöhten Sturzrisikos und des Abhängigkeitspotentials nicht bedarfsabhängig oder unregelmäßig, sondern unbedingt absolut konstant nachrangig zur Anwendung kommen. Nebenwirkungen wie Übelkeit, Koordinationsstörungen, Müdigkeit lassen bei konstanter Dosierung meist nach Tagen nach. Als relativer Partialagonist für den μ-Opioidrezeptor bietet das transdermale Buprenorphin, sowie wegen der niedrigen Rezeptorwirkung das Tapentadol, bei älteren Patienten Vorteile zu anderen Opiaten.
- Ggf. können Antidepressiva (Amitriptylin und selektive Serotonin-Noradrenalin-Wiederaufnahmehemmer, SSNRI) oder Antikonvulsiva (Gabapentin, Pregabalin) hilfreich sein. Gerade bei serotoninergen Substanzen ist jedoch die knochenabbauende Wirkung zu beachten.
Im Rahmen der multimodalen Schmerztherapie sollten nicht-medikamentöse Ansätze bei Osteoporosepatienten immer eine besonders prominente Rolle spielen. Dazu gehören [26-28]:
- Physiotherapie kann Schmerzen lindern und die Gelenkbeweglichkeit verbessern.
- Wärmetherapie kann Muskelverspannungen lösen und die Durchblutung fördern.
- Kältetherapie kann Entzündungen reduzieren und Schmerzen lindern.
- Geeignete orthopädietechnische Hilfsmittel
- Transkutane elektrische Nervenstimulation (TENS) kann die Schmerzwahrnehmung reduzieren.
Spezifische medikamentöse Therapie der Osteoporose
Frakturrisikostratifizierung zur Indikationsstellung einer medikamentösen Therapie
Für die Indikationsstellung einer spezifischen medikamentösen Osteoporosetherapie legt die neue Leitlinie 2023 Risikoschwellen für ein prädiktives absolutes, individuelles 3-Jahres-Risiko kumulativ für vertebrale und Schenkelhalsfrakturen zugrunde.
Zur Indikationsstellung einer spezifischen medikamentösen Osteoporosetherapie bedarf es der Berücksichtigung aller Risikofaktoren und Befunde in ihrer Gesamtheit: Anamnese mit Erfassung der Risikofaktoren, Vorliegen von Indikatorfrakturen, Ergebnisse der klinischen Untersuchung, Labordiagnostik, Knochendichtemessung mittels DXA, ggf. Bildgebung.
Die Indikation zur spezifischen medikamentösen Therapie kann nach Berechnung des individuellen absoluten 3-Jahres-Risikos des Patienten dann aus der Tabelle der Leitlinie zur Therapieempfehlung gestellt werden [1] (Tab. 1).
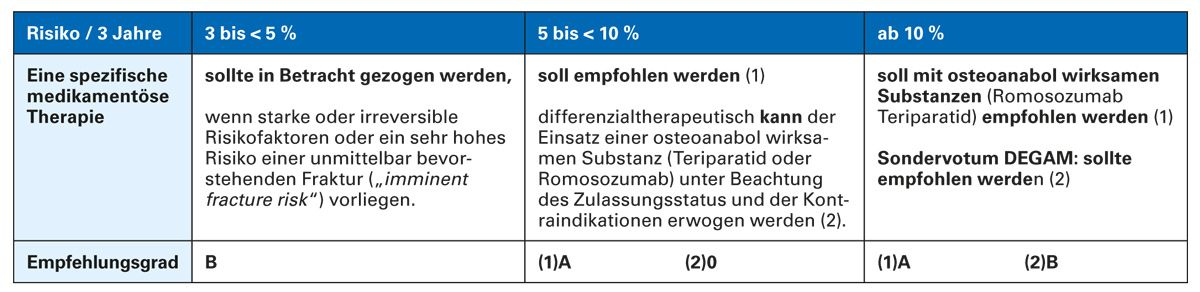
Tab. 1: Zusammenfassung der Empfehlungen zur Indikation für eine medikamentöse Osteoporosetherapie [adaptiert nach 1]
Die Risikoberechnung des 3-Jahres-Frakturrisikos erfolgt auf der Basis eines mathematischen Algorithmus, der das Geschlecht, das Alter, den Gesamt-Gradienten der einzelnen Risikofaktoren und die gemessene Knochendichte über dem Totalareal der Hüften mittels der DXA-Methode berücksichtigt.
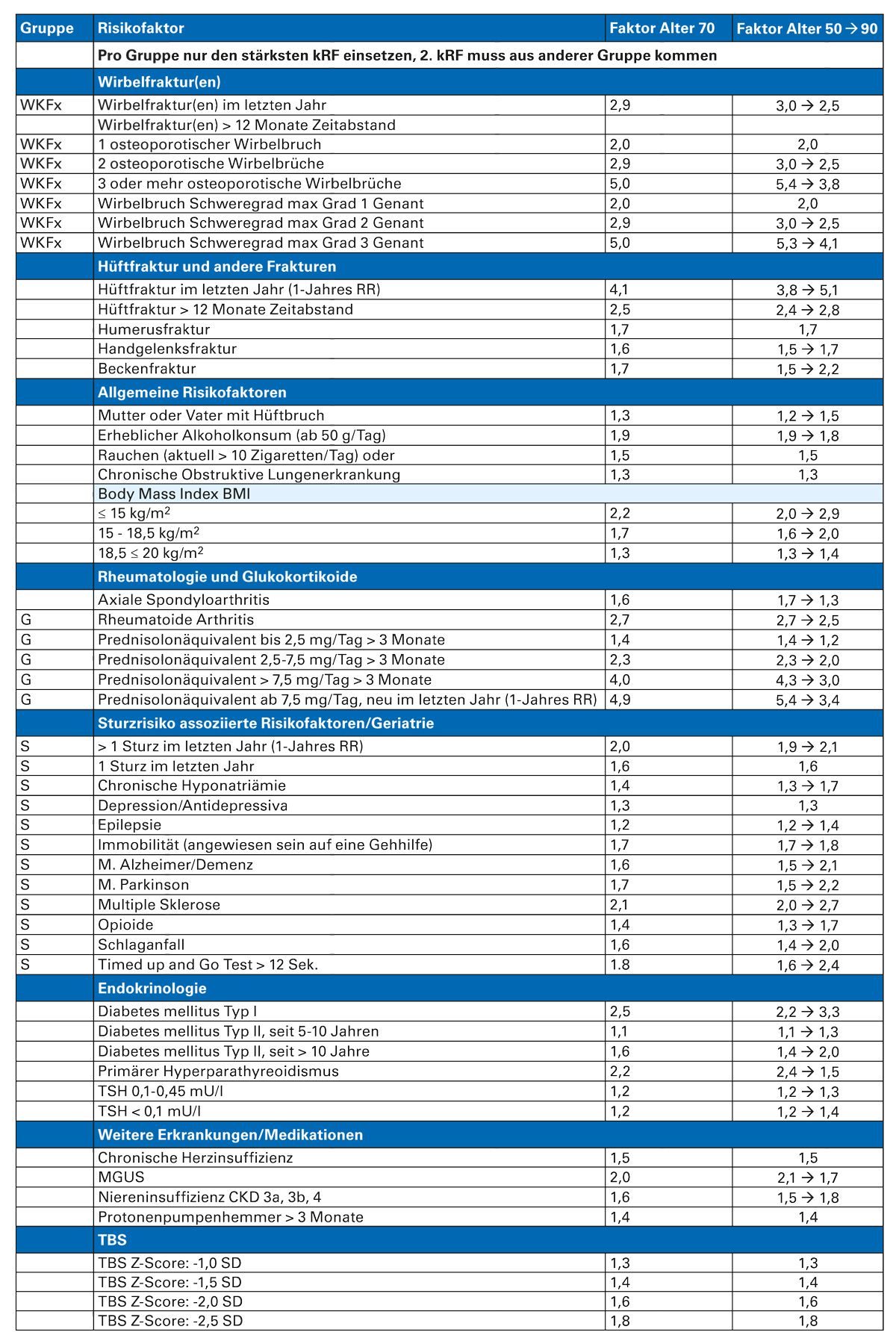
Hierzu werden aus einer anderen Tabelle der Leitlinie, die alle relevanten Risikofaktoren der Einzelrisiken altersadapiert enthält (Tab. 2), die speziell bei dem Patienten vorliegenden Risikofaktoren entnommen.
Maximal 2 Risikogradienten aus unterschiedlichen Risikogruppen werden dann miteinander multipliziert, um den maßgeblichen Risikogradienten des Patienten zu ermitteln.
Über diesen Gradienten kann dann anhand der bekannten übrigen Parameter (Geschlecht, Alter, T-Wert) mittels der sechs Tabellen der Leitlinie (Tab. 3) ermittelt werden, ob und welche der für die Therapie maßgebliche Risikoschwelle, 3-5 %, 5-10 % und über 10 %, ein Patient überschreitet.
Damit lässt sich festlegen, ob und welche medikamentöse Therapie der Patient erhält.
In absehbarer Zeit wird eine App zur automatisierten Berechnung zur Verfügung gestellt werden.
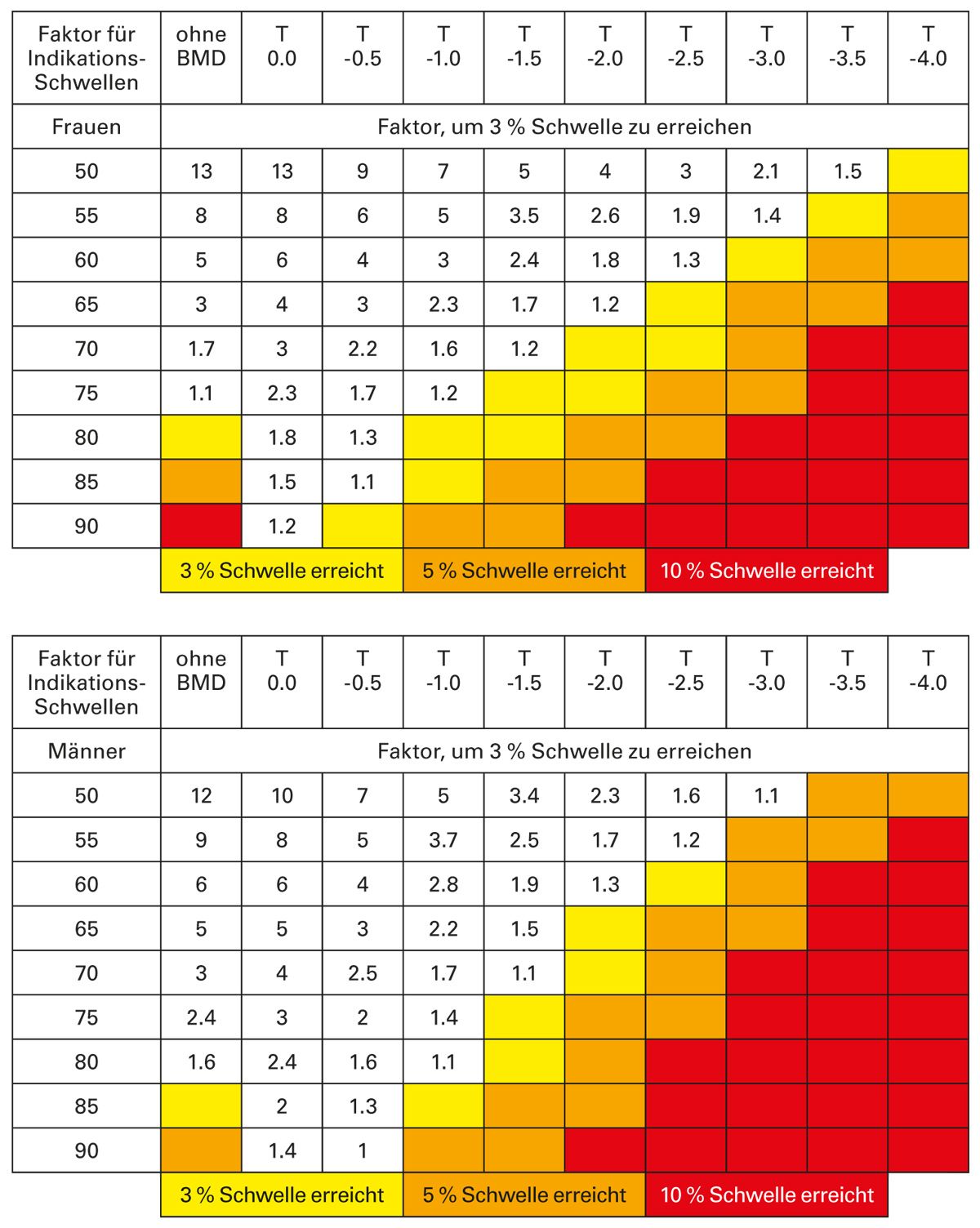
Tab. 3: Zwei Beispiele von sechs Tabellen: 3 %, 5 % und 10 %-Frakturrisiko-Schwellen pro 3 Jahre für Frauen und Männer zur Ableitung einer Therapieempfehlung [adaptiert nach 1]
Bei einigen schweren Risikokonstellationen wird eine rasche medikamentöse Osteoporosetherapie auch ohne weitere Berechnung des individuellen Frakturrisikos erforderlich:
- Niedrig traumatische multiple Wirbelfrakturen oder singuläre 2. oder 3. Grades nach Genant
- Proximale Femurfrakturen
- Aktuelle oder absehbare systemische Kortisontherapie länger als 3 Monate mit mehr als 7,5 mg Prednisolonäquivalent, falls niedrig traumatische Wirbelfrakturen oder mehr als eine periphere Fraktur vorbestehen oder alternativ der niedrigste relevante T-Wert weniger als -1,5 beträgt
Medikamentöse Therapieoptionen und Differenzialtherapie
Es stehen eine Reihe an Substanzen zur Verfügung, die mit höchster Evidenz das Risiko für osteoporotische Frakturen wirksam verringern können. Es gibt zwei Therapieprinzipien. Antiresorptive Substanzen bremsen den Knochenabbau und verbessern die Bilanz des Knochenumbaus. Osteoanabole Medikamente fördern den Knochenaufbau:
Bisphosphonate lagern sich bevorzugt an Knochenoberflächen an, die aktuell umgebaut werden. Sie werden im Knochen langfristig eingebaut. Durch Aufnahme in die Osteoklasten hemmen sie deren Anheftung an die Knochen sowie die Sezernierung von Säure und Kollagenasen. Nach Verlust des Kontakts zur Knochenoberfläche kommt es zur Apoptose der Osteoklasten. Gleichzeitig werden Osteoblasten reaktiviert, was langfristig zu einer positiven Knochenmassebilanz führt [17].
Für die Einnahme oraler Bisphosphonate sollen die Patienten 30 min aufrecht sitzen können, die Nierenfunktion muss über einer glomerulären Filtrationsrate (GFR) > 30 ml/min liegen sowie die zu erwartende Compliance hoch sein [1]. Intravenös applizierte Bisphosphonate kommen zum Einsatz, wenn eine enterale Gabe nicht möglich ist. Voraussetzung hierfür ist eine GFR > 30 ml/min [1].
Denosumab ist ein humaner monoklonaler Antikörper, der subkutan appliziert wird (60 mg/6 Monate). Er hemmt die Bindung von RANKL an RANK und verhindert so die Bildung von Osteoklasten. Bei Patienten mit renalen Funktionsstörungen ist bei Denosumab keine Dosisanpassung erforderlich. Vorteile liegen auch in der unkomplizierten subkutanen Applikation sowie in der relativ hohen Therapieadhärenz. Sie ist entscheidend für die Reduktion des Frakturrisikos. Wegen der Gefahr eines potenziellen Rebound-Effektes darf Denosumab nicht ersatzlos abgesetzt werden.
In Studien konnte für Denosumab eine Therapieadhärenz über 12 Monate >80 % erreicht werden, nach 24 Monaten zeigte sich immer noch eine sehr hohe Therapieadhärenz von etwa 65 % [29-30]. Vor Beginn der Therapie muss ein normwertiger Kalziumserumspiegel vorliegen. Empfohlen werden vor Therapiebeginn mit Denosumab auch eine Vitamin-D-Spiegel-Kontrolle sowie ggf. der Ausgleich eines bestehenden Mangels.
Hinsichtlich des möglichen Risikos für Kiefernekrosen ist prinzipiell vor Beginn einer antiresorptiven Therapie auf den Zahnstatus bzw. bei Zahnprothesen auf den Zustand der Kiefer des Patienten zu achten [31]. Der Therapiebeginn sollte deswegen aber nicht hinausgezögert werden.
Selektive Östrogenrezeptor-Modulatoren (SERM’s) haben als Target den Östrogenrezeptor des Knochens und wirken mehr antiresorptiv als osteoanabol.
Im Gegensatz zu den antiresorptiven Substanzen können anabol wirkende Substanzen über eine Stimulierung der Osteoblasten eine stete Zunahme der Knochenmasse bewirken. Osteoanabole Therapien sind in Anbetracht des Aufwandes und der Wirtschaftlichkeit bei schwerem Verlauf einer (manifesten) Osteoporose und bei Patienten mit deutlich erhöhtem Frakturrisiko indiziert.
Teriparatid ist eine verkürzte, rekombinante Form des humanen Parathormons, die zu einem (Wieder-)Aufbau von Knochensubstanz führt und in einer Dosis von 20 μg 1xtäglich subkutan durch die Patienten selbst injiziert wird. Kontraindikationen sind u.a. eine Hyperkalzämie oder eine schwere Niereninsuffizienz (GFR < 30 ml/min). Teriparatid ist für eine maximale Therapiedauer von 24 Monaten zugelassen. Im Anschluss sollte eine Sequenz mit antiresorptiver Therapie folgen. Ein Therapiewechsel von Teriparatid auf Denosumab und zurück zeigte vielversprechende Ergebnisse hinsichtlich der Zunahme der Knochenmineraldichte an Hüfte und Wirbelsäule [32].
Romosozumab hemmt spezifisch das Glykoprotein Sclerostin und führt so zu einer Aktivierung der Osteoblasten und damit zu einer verstärkten Produktion von Knochenmatrix. Zusätzlich hemmt Romosozumab den Knochenabbau durch Verringerung der Expression von Osteoklastenmediatoren. Romosozumab ist zugelassen zur Behandlung der Osteoporose bei postmenopausalen Frauen mit manifester Osteoporose und deutlich erhöhtem Frakturrisiko. Die Therapiedauer beträgt 12 Monate.
Im Anschluss an die zeitlich limitierte osteoanabole Therapie ist die Fortsetzung mit antiresorptiven Medikamenten, z. B. Bisphosphonaten oder Denosumab, langfristig wichtig [33].
Für Frauen ist auch die Hormontherapie direkt nach Eintritt in die Menopause eine Möglichkeit, das Frakturrisiko zu senken [34]. Sie ersetzt bei entsprechender Indikation nach der Leitlinie jedoch keine vollwertige medikamentöse Osteoporosetherapie. Die postmenopausale Hormontherapie ist aus osteologischer Sicht eine antiresorptive Therapieform, da die Osteoklasten in ihrer Funktion moduliert werden. Die positiven Effekte auf den Knochenstoffwechsel sind additiver Zusatznutzen einer Hormontherapie, die aufgrund vasomotorischer Symptomatik von Gynäkologen empfohlen werden kann, nach den Empfehlungen der S3-Leitlinien zur „Peri- und Postmenopause-Diagnostik und Interventionen“ sogar in dieser Situation angeboten werden soll [35].
Neues aus der aktuellen Leitlinie
Dieser CME Fortbildung liegt die aktuelle deutsche S3-Leitlinie 2023 des DVO zugrunde. Sie ist im Vergleich zur Leitlinienversion 2017 komplett überarbeitet. Das betrifft vor allem das Kapitel 4 (Risikofaktoren). Auf Basis einer umfassenden systematische Literaturrecherche und ergänzt durch Experten-Handsearch zu Risikofaktoren für Wirbelfrakturen und Schenkelhalsfrakturen ist diese Aufstellung gleichzeitig Grundlage für die Entwicklung eines Risikorechners für das vertebrale und Schenkelhalsfrakturrisiko [1].
Der Risikorechner umfasst jetzt 33 priorisierte Risikofaktoren (inklusive Alter), die in die Kalkulation des Frakturrisikos eingehen. Neu dazugekommen sind Humerusfrakturen, Beckenfrakturen, chronische Hyponatriämie, Herzinsuffizienz, Niereninsuffizienz, Multiple Sklerose sowie ein Timed up and Go-Test > 12 Sekunden. Neu aufgenommene, aber nicht in der Risikokalkulation des Risikorechners berücksichtigte Risikofaktoren sind ein Systemischer Lupus erythematodes, Immobilität, Frailty, HIV sowie bariatrische Operation. Neu ist auch die Beachtung von Risikofaktoren, die das imminente Frakturrisiko erhöhen: Wirbelkörperfraktur, Schenkelhalsfraktur, zwei Stürze und mehr innerhalb der zurückliegenden 12 Monate, > 5 mg Prednisolon > 3 Monate innerhalb der letzten 12 Monate [1].
Eine regelmäßige Sturzanamnese unter Einschluss des Timed up and Go-Tests sollte ab einem Patientenalter von 70 Jahren durchgeführt werden. Bei auffälligem Befund sollten Maßnahmen zur Verbesserung der Muskelkraft und Gangkoordination angeboten werden.
Im Bereich der Diagnostik wurde die Schwelle zur Basisdiagnostik fallen gelassen. Neue Daten zum vertebralen Fraktur Assessment im Rahmen der DXA sowie für die hochauflösende periphere Computertomografie wurden ergänzt. Die Serum-Eiweißelektrophorese wird als fester Bestandteil des Basislabors aufgenommen, die Bestimmung von CRP und BSG im Basislabor empfohlen.
Bei der Basistherapie sind neben den Empfehlungen zu Calcium und Vitamin D Empfehlungen zur Dosis von Vitamin D und bei Mangel zur Supplementierung von Vitamin K2 aufgenommen. Für die medikamentöse Therapie wird das Frakturrisiko jetzt über 3 Jahre bestimmt, nicht wie bis zuletzt über 10 Jahre. Auch die Schwellenwerte als Indikation für die Einleitung der medikamentösen Therapie wurden aktualisiert. Ab einem Risiko von 3-5 % (bezogen auf die 3 Jahre) sollte eine Therapie in Betracht gezogen und ab 5 % empfohlen werden. Ab einem Risiko von 10 % soll eine Therapie mit osteoanabol wirksamen Substanzen empfohlen werden.
Bereits im Januar 2023 hat das American College of Physicians (ACP) seine aktualisierten Empfehlungen vorgestellt. Dazu gehören folgende Empfehlungen [36]:
- Zur Verringerung des Frakturrisikos bei postmenopausalen Frauen und bei Männern, bei denen eine primäre Osteoporose diagnostiziert wurde, wird der Einsatz von Bisphosphonaten als Erstlinie empfohlen.
- Für Patienten, die gegen Bisphosphonate kontraindiziert sind oder bei denen diese unerwünschte Wirkungen haben, wird Denosumab als Zweitlinienbehandlung empfohlen.
- Für Frauen mit primärer Osteoporose und einem sehr hohen Frakturrisiko wird Romosozumab oder Teriparatid empfohlen, gefolgt von einem Bisphosphonat.
- Bei Frauen, die älter als 65 Jahre sind und an Osteopenie leiden, sollte individuell entschieden werden, ob eine pharmakologische Behandlung mit einem Bisphosphonat begonnen werden soll.
Auch die US-amerikanische Bone Health and Osteoporosis Foundation (BHOF) hat 2022 ein Konsensuspapier zur Prävention und Behandlung der Osteoporose veröffentlicht [37]. Die dort publizierten Empfehlungen decken sich weitgehend mit denen der aktualisierten deutschen Leitlinie.
Orthopädische Hilfsmittel
Orthopädische Hilfsmittel können eine wichtige Rolle bei der Verbesserung der Lebensqualität und Unabhängigkeit von Patienten mit Osteoporose spielen. Dabei geht es um Verbesserung der Mobilität, Stabilisierung von Gelenken, Schmerzlinderung und Vorbeugung von Frakturen. Die Auswahl der geeigneten Hilfsmittel sollte in Zusammenarbeit mit einem Physiotherapeuten oder Orthopädietechniker erfolgen, um eine optimale Passform und Funktion zu gewährleisten.
Gehhilfen wie Gehstöcke, Unterarmgehstützen oder Rollatoren können die Stabilität und das Gleichgewicht von Patienten mit Osteoporose verbessern, indem sie zusätzliche Unterstützung bieten und das Körpergewicht besser verteilen. Die Wahl der geeigneten Gehhilfe hängt von den individuellen Bedürfnissen und Fähigkeiten des Patienten ab.
Orthesen können bei Osteoporose eingesetzt werden, um die betroffenen Gelenke zu stabilisieren und Schmerzen zu lindern. Der Effekt kann durch eine begleitende Physiotherapie verstärkt werden. Das Tragen einer Orthese ist insbesondere in der Anfangsphase der medikamentösen Osteoporosetherapie sinnvoll, da die Normalisierung des Knochenumbaus mehrere Monate Therapie in Anspruch nehmen kann [38-40].
Orthesen können über die propriozeptive Wirkung den Muskelaufbau unterstützen und Schmerzen verringern. Das ist vor allem zu Beginn der Behandlung wichtig, um eine frühe Mobilisation der Patienten zu ermöglichen. Das wiederum unterstützt die Stärkung der Rumpfmuskulatur, was maßgeblich für den langfristigen Behandlungserfolg ist [41].
Verschiedene Orthesen können eingesetzt werden. Elastische bzw. teilflexible Rumpforthesen entlasten die Wirbelsäule durch eine allseitige Kompression des Abdomens. Um bei typischen stabilen osteoporotischen Keilfrakturen einer Muskelatrophie und Demineralisierung entgegenzuwirken, sollten leichte Orthesen eingesetzt werden, in weniger gravierenden Situationen dynamische Orthesen.
Eine aktuelle Auswertung von 2023 zum Einsatz von Wirbelsäulenorthesen kommt zum Schluss, dass nach dem Anlegen die Schmerzen nachlassen und die Lebensqualität sich mit der Zeit verbessert [42]. Betont wird aber auch, dass zu wenig qualitativ hochwertige Studien vorliegen, um zu entscheiden, ob es sich um tatsächliche Vorteile gegenüber einem wait-and-see-Vorgehen handelt.
Zur Vorbeugung von Frakturen können Hüftprotektoren zum Einsatz kommen. Die gepolsterten Plastikschalen schützen die typische Aufprallregion bei einem Sturz und können das Frakturrisiko um bis zu 50 % senken. Allerdings ist die Akzeptanz gering, was ihre Wirksamkeit in der Praxis einschränkt. Eine Physiotherapie, die auf Gleichgewichtsübungen und Krafttraining abzielt, kann ebenfalls dazu beitragen, das Sturzrisiko zu reduzieren [43].
Operative Therapie
Wenn medikamentöse und andere konservative Therapieansätze zur Behandlung von osteoporotischen Frakturen nicht zum Erfolg führen, können operative Verfahren bei bestimmten Patienten infrage kommen. Die Zementaugmentation kann bei Patienten mit einer akuten vertebralen Kompressionsfraktur mit Ödem in der MRT in Erwägung gezogen werden, die über erhebliche Schmerzen berichten und die immobilisiert sind, oder bei Patienten, die nicht innerhalb von 3 bis 6 Wochen auf eine konservative Therapie ansprechen [44].
Die Osteoplastien sind effektive interventionelle Verfahren zur Schmerzreduktion bei Wirbelkörperfrakturen unterschiedlicher Ätiologie. Bei der Kyphoplastie handelt es sich um eine spezielle Form der Wirbelkörperaugmentation, bei der zunächst ein Ballonkatheter in den betroffenen Wirbelkörper eingeführt und aufgeblasen wird, um den Wirbel aufzurichten und Raum für den Knochenzement zu schaffen. Bei der Vertrebroplastie wird der Knochenzement direkt in den gebrochenen Wirbelkörper injiziert, ohne zuvor einen Ballonkatheter zu verwenden. Klinisch relevante Komplikationen treten in weniger als 1 % der Fälle auf und das Risiko für eine Fraktur eines benachbarten Wirbelkörpers ist nach VP/KP wohl nicht erhöht [45].
Orthopädische Implantate können bei Patienten mit Osteoporose in Betracht gezogen werden, wenn bestimmte Frakturen eine chirurgische Intervention erfordern. Hierbei kommen Prothesen wie Hüft- oder Kniegelenksersatz, Platten, Schrauben oder intramedulläre Nägel zum Einsatz [46].
Für die angemessene chirurgische perioperative Versorgung gibt es gemeinsame Richtlinien der European League Against Rheumatism (EULAR) und der European Federation of National Associations of Orthopaedics and Traumatology (EFORT). Diese umfassen auch Hinweise zur Reduzierung des zukünftigen Frakturrisikos. Dabei wird die hohe Bedeutung von Maßnahmen zur Rehabilitation und Patientenschulung betont [47].
Fazit
- Osteoporose zählt zu den zehn weltweit am häufigsten auftretenden Erkrankungen. Es besteht gerade in Deutschland eine große Behandlungslücke.
- Die Awareness für das Risiko und das Problem einer Osteoporose ist Pflicht eines jeden Arztes.
- Bei Menschen über 50 Jahre und postmenopausalen Frauen sollen gemäß der Strategie der „Case-Findung“ Risikofaktoren evaluiert werden und bei Indikation eine Basisdiagnostik eingeleitet werden.
- Gefährdet sind v. a. Patienten ab dem 70. Lebensjahr. Bei Ihnen sollte eine regelmäßige Sturzanamnese unter Einschluss des Timed up and Go Tests durchgeführt werden. Bei erhöhtem Risiko ist eine Basisdiagnostik zu veranlassen.
- Bei allen Menschen mit einem erhöhten Osteoporoserisiko sind Basismaßnahmen zur Prävention wie auch adjuvant zur Therapie verpflichtend.
- Bei einem 3-Jahres-Risiko für schwere osteoporotische Frakturen von über 5 % soll eine spezifische Osteoporosemedikation verordnet werden.
- Bei sehr hohem Frakturrisiko sollen Patienten mit osteoanabolen Präparaten behandelt werden, im Therapieverlauf folgt eine antiresorptive Anschlusstherapie.
- Zur Verbesserung der Therapieadhärenz sollen individuelle Lösungen gesucht werden.
- Orthopädische Hilfsmittel können eine wichtige Rolle bei der Verbesserung der Lebensqualität und Unabhängigkeit von Patienten mit Osteoporose spielen.
Literatur
- DVO, Dachverband der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften e. V. Prophylaxe, Diagnostik und Therapie der Osteoporose bei postmenopausalen Frauen und bei Männern ab dem 60. Lebensjahr 2023. Langfassung V 2.1 AWMF-Register-Nr.: 183/001. Online abrufbar unter: https://dv-osteologie.org/ osteoporose-leitlinien
- Consensus Development Conference: Diagnosis, prophylaxis, and treatment of osteoporosis. Am J Med 1993; 94: 646-650
- WHO Study Group Assessment of fracture risk and its application to screening for postmenopausal osteoporosis 1994. https://apps.who.int/iris/handle/10665/39142, abgerufen am 11.04.2023
- Hadji P et al (2013) Epidemiologie der osteoporose: Bone evaluation study: Eine Analyse von Krankenkassen-Routinedaten. Dtsch Arztebl Int 110: 52–57
- Seeman E (2003) Pathogenesis of Bone Fragility in Women and Men. Lancet 361: 1802-1808
- Canalis E et al (2007) Glucocorticoid-induced osteoporosis: pathophysiology and therapy. Osteopor Int 18; 1319-1328
- Moe SM, Drüeke TB (2003) Management of secondary hyperparathyroidism: The importance and the challenge of controlling parathyroid hormone levels without elevating calcium, phosphorus, and calcium-phosphorus product. Am J Nephrol 23: 369-379
- Goldring SR, Goldring MB (2004) The role of cytokines in cartilage matrix degeneration in osteoarthritis. Clin Orthopaed Rel Res 427 Suppl: S27-S36
- van Staa TP et al (2002) The epidemiology of corticosteroid-induced osteoporosis: A meta-analysis. Osteoporos Int 13: 777-787
- Lassen MR et al (2005) Use of low-molecular-weight heparin for the long-term prevention of symptomatic venous thromboembolism: A meta-analysis of randomized trials. J Thromb Haemostas 3: 857-864
- Geisler J (2003) Breast cancer tissue estrogens and their manipulation with aromatase inhibitors and inactivators. J Steroid Biochem Mol Biol 86: 245-253
- Yang YX et al (2006) Long-term proton pump inhibitor therapy and risk of hip fracture. JAMA 296: 2947-2953
- International Osteoporosis Foundation. Facts and statistics 2021. https://www.iofbonehealth.org/facts-statistics, abgerufen am 2.05.2023
- Johnell O, Kanis JA (2006) An estimate of the worldwide prevalence and disability associated with osteoporotic fractures. Osteoporos Int 17: 1726-1733
- NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy. JAMA 2001; 285: 785-795
- Ralston SH, Uitterlinden AG (2010) Genetics of osteoporosis. Endocrine Rev 31: 629-662
- Bartl R (2022) Osteoporose in der Praxis. Springer Nature, e-ISBN 978-3-662-64207-8
- Eastell R, Szulc P (2017) Use of bone turnover markers in postmenopausal osteoporosis. Lancet Diabet Endocrinol 5: 908-923
- Bhasin S, Cunningham GR (2013) Testosterone therapy in men with androgen deficiency syndromes: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metabol 95: 2536-2559
- Ferrari SL (2018) Human genetics of osteoporosis. Best Pract Res Clin Endocrinol Metabol 32: 703-716
- Blake GM, Fogelman I (2007) The role of DXA bone density scans in the diagnosis and treatment of osteoporosis. Postgrad Med J 83: 509-517
- Stumpf U et al (2022) Osteoporose: Diagnostik und Behandlung. Z Gerontol Geriatr 55: 703-714
- Breivik H et al (2006) Survey of chronic pain in Europe: Prevalence, impact on daily life, and treatment. Eur J Pain 10: 287-333
- BÄK, KBV, AWMF (2017) Nationale Versorgungsleitlinie: Nicht-spezifischer Kreuzschmerz, Kurzfassung, 2. Auflage. AWMF-Register-Nr.: nvl-007
- Taghizadeh H, Benrath J (2019) Pocket Guide Schmerztherapie. Springer-Verlag 17
- Kuithan P, Rushton A, Heneghan NA (2022) Schmerzmodellierung durch Bewegung – Bewegungsinduzierte Hypoalgesie in der Physiotherapie. Schmerz 36: 237-241
- Nadler SF et al (2004) The physiologic basis and clinical applications of cryotherapy and thermotherapy for the pain practitioner. Pain Physician 7: 395-399
- Johnson M, Martinson M (2007) Efficacy of electrical nerve stimulation for chronic musculoskeletal pain: A metaanalysis of randomized controlled trials. Pain 130: 157-165
- Hadji P et al (2015) Persistence, adherence, and medication-taking behavior in women with postmenopausal osteoporosis receiving denosumab in routine practice in Germany, Austria, Greece, and Belgium: 12-month results from a European non-interventional study. Osteoporos Int 26: 2479-2489
- Fahrleitner-Pammer A et al (2017) Factors associated with high 24-month persistence with denosumab: results of a real-world, non- interventional study of women with postmenopausal osteoporosis in Germany, Austria, Greece, and Belgium. Arch Osteoporos 12: 58
- Schiegnitz E et al. Antiresorptiva-assoziierte Kiefernekrosen(AR-ONJ) S3-Leitlinie 2018. https://register.awmf.org/de/ leitlinien/detail/007-091, abgerufen am 11.04.2023
- Leder BZ et al (2015) Denosumab and teriparatide transitions in postmenopausal osteoporosis (theDATA-Switchstudy): extension of a randomised controlled trial. Lancet 386: 1147-1155
- Lewiecki EM et al (2019) One year of romosozumab followed by two years of denosumab maintains fracture risk reductions: results of the FRAME extension study. J Bone Miner Res 34: 419-428
- Thomasius F (2023) Wesentliche Aspekte der Osteoporose-Versorgung. Privatarzt Gynäkol 14(2): 8-11
- S3-Leitlinie Peri- und Postmenopause. Diagnostik und Interventionen. https://www.awmf.org/uploads/tx_szleitlinien/015-062l_S3_HT_Peri-Postmenopause-Diagnostik-Interventionen_2021-01.pdf, abgerufen am 11.04.2023
- Qaseem A et al (2023) Pharmacologic Treatment of Primary Osteoporosis or Low Bone Mass to Prevent Fractures in Adults: A Living Clinical Guideline from the American College of Physicians. Ann Intern Med 176: 224-238
- LeBoff MS et al (2022) The clinician’s guide to prevention and treatment of osteoporosis. Osteopor Int 33: 2049-2102
- Bartl R (Hrsg) Klinische Osteologie. Georg Thieme Verlag 2014
- Hubscher M et al (2010) Prospective evaluation of the effects of a spinal orthosis on physical function and quality of life in women with osteoporosis. Z Orthop Unfall 148: 443-447
- Fink M et al (2007) Efficacy of a flexible orthotic device in patients with osteoporosis on pain and activity of daily living. J Rehabil Med 39: 77-80
- Nagel-Albustin K, Preisinger E (2012) Propriozeptive Orthesen bei Osteoporose. J Miner Stoffwechs 19: 120-123
- Pieroh P et al (2023) Spinal Orthoses in the Treatment of Osteoporotic Thoracolumbar Vertebral Fractures in the Elderly: A Systematic Review with Quantitative Quality Assessment. Global Spine Journal 13: 59S-72S
- Sherrington C et al (2019) Exercise for preventing falls in older people living in the community. Cochrane Database Syst Rev , CD012424
- Benditz A, Jerosch J (2023) Osteoporotische Wirbelkörperfrakturen – Von der Diagnose zur Therapie. Z Rheumatol 82: 18-24
- Kangner S, Henker C (2020) Vertebroplastie und Kyphoplastie – eine kritische Stellungnahme. Radiologe 60: 138-143
- Fink B (2014) Implantatversorgung von Frakturen bei Osteoporose. Orthopäde 43: 687-694
- Lems WF et al (2017) EULAR/EFORT recommendations for management of patients older than 50 years with a fragility fracture and prevention of subsequent fractures. Ann Rheum Dis 76: 802-810
- DIMDI, Deutsches Institut für medizinische Dokumentation und Information, ICD-10-GM Version 2008 – Onlinezugriff (dimdi.de) , abgerufen am 06.01.2024
Bildquellen
Titel: Bauerfeind
Abb. 2: © Peter Hermes Furian – stock.adobe.com
Hinweis:
Aus Gründen der besseren Lesbarkeit wird auf die gleichzeitige Verwendung der Sprachformen männlich, weiblich und divers (m/w/d) verzichtet. Entsprechende Begriffe gelten im Sinne der Gleichbehandlung grundsätzlich für alle Geschlechter. Die verkürzte Sprachform beinhaltet keine Wertung.

Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der arztCME-Online-Akademie erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.