Transplantationsinfektiologie: Update Herpesvirusinfektionen nach Tx
Interessengebiete: Allgemeinmedizin und Innere Medizin, Immunologie, Transplantationsmedizin, Zukunft Transplant
Die Herpesvirus-Familie umfasst acht menschliche Herpesviren, von denen Cytomegalievirus (CMV), Epstein-Barr-Virus (EBV), Herpes-simplex-Virus Typ 1/2 (HSV-1/2) und Varizella-Zoster-Virus (VZV) nach der Transplantation von hoher klinischer Relevanz sind. Expertinnen und Experten aus Infektiologie, Immunologie, Organ- und Stammzelltransplantation geben in dieser CME einen Überblick zu aktuellen Empfehlungen zu Screening, Diagnostik, Prävention und Behandlung dieser Virusinfektionen. Ein besonderer Fokus liegt auf refraktären und resistenten CMV-Infektionen nach Transplantation sowie den neuesten Entwicklungen im Management dieser komplexen Infektionen, die anhand realer Fallbeispiele aus der klinischen Praxis veranschaulicht werden.
Kursinhalt
Inhaltsverzeichnis
- Einleitung
- Begrüßung und Einführung
- Flashlight HSV post-SOT/-HSZT
- VZV nach allogener HSZT
- Virusinfektionen post-Tx – Flashlight EBV
- Q&A
- Überleitung Spotlight r/r CMV-Infektion nach Tx
- Neues zu Infektionen nach Organtransplantation Teil 1
- CMV-Management nach Organtransplantation
- CMV-Management nach allogener HSZT
- Neues zu Infektionen nach Organtransplantation Teil 2
- Patientenkasuistik – Refraktäre CMV-Infektion nach allogener HSZT
- Q&A
- Referenzen
- Bildquellen
Einleitung
Die Herpesvirus-Familie umfasst acht menschliche Herpesviren, von denen Cytomegalievirus (CMV), Epstein-Barr-Virus (EBV), Herpes-simplex-Virus Typ 1/2 (HSV-1/2) und Varizella-Zoster-Virus (VZV) nach der Transplantation von hoher klinischer Relevanz sind. Expertinnen und Experten aus Infektiologie, Immunologie, Organ- und Stammzelltransplantation geben in dieser CME einen Überblick zu aktuellen Empfehlungen zu Screening, Diagnostik, Prävention und Behandlung dieser Virusinfektionen. Ein besonderer Fokus liegt auf refraktären und resistenten CMV-Infektionen nach Transplantation sowie den neuesten Entwicklungen im Management dieser komplexen Infektionen, die anhand realer Fallbeispiele aus der klinischen Praxis veranschaulicht werden.
Begrüßung und Einführung
Prof. Dr. med. Christina T. Rieger
Sehr geehrte Kolleginnen und Kollegen, herzlich willkommen zu Zukunft Transplant, eine fächerübergreifende Fortbildung. Herzlich willkommen. Mein Name ist Christina Rieger. Ich bin Fachärztin für Hämatologie und internistische Onkologie. Gemeinsam mit meiner sehr geehrten Kollegin Frau Prof. Sester, Leiterin der Transplantations- und Infektionsimmunologie an der Universität des Saarlandes in Homburg, heißen wir Sie sehr, sehr herzlich willkommen zu dieser fächerübergreifenden Fortbildungsveranstaltung, in der wir die Relevanz von Virusinfektionen sowohl für die solide Organtransplantation als auch für die hämatopoetische Stammzelltransplantation beleuchten wollen. Für den Part Virusinfektionen nach der Transplantation sollen wir kurze Flashlights zu EBV, HSV und VZV haben. Ich freue mich sehr, meinen langjährigen Kollegen und Weggefährten, Herrn Dr. Daniel Teschner, Oberarzt am Universitätsklinikum Würzburg, begrüßen zu dürfen. Herr Dr. Teschner leitet die Abteilung für Stammzellentransplantation an der Uniklinik Würzburg. Daniel, Du wirst uns zu HSV updaten. Ich freue mich und ich bin ganz gespannt, auch wenn ich nicht bei Euch sein kann. Vielen Dank.
00:01:19
Flashlight HSV post-SOT/-HSZT
Dr. med. Daniel Teschner
Liebe Christina, liebe Frau Prof. Sester, vielen Dank für die sehr sympathische Anmoderation. Es hat tatsächlich von dem Flughafen, von dem aus ich geflogen bin, funktioniert. Im Süden hat es wohl nicht funktioniert, aber schön, dass Du virtuell dabei bist und uns unterstützt. Ich darf den Reigen mit vielleicht dem Simpelsten eröffnen, wenn man so möchte, dem Herpes-simplex-Virus und mit den Problemen, mit denen wir nach der Transplantation zu kämpfen haben. Das sind meine Interessenskonflikte. Wir haben nach der allogenen hämatopoetischen Stammzellentransplantation, das ist mein Kerngeschäft, diese spezielle Situation, dass das Immunsystem recht lange braucht, bis es wieder komplett am Start ist. Die Granulozyten kommen relativ früh. Sie sind nach etwa 20 bis 30 Tagen wieder am Start, die Neutropenie ist abgeschlossen. Das spezifische Immunsystem, die T- und die B-Zellen, brauchen sehr, sehr lange. Wir brauchen ein gutes halbes Jahr, bis wir wieder einen gewissen Basisschutz haben. Diese Zeit nutzen die Viren, die in unseren Patienten schlummern, um zu reaktivieren.
Wir haben die Infektionen, natürlich. Dieser große gelbe Block stellt die Virusreaktivierungen dar. Das Herpes-simplex-Virus ist tatsächlich etwas, was vielleicht manch- mal ein wenig unterschätzt wird, aber doch eine hochrelevante Rolle spielt, weil die Durchseuchungsrate recht hoch ist. Die Gruppe an sich, die Familie, ist riesig. Es gibt sehr, sehr viele Herpesviridae. Wenn wir uns jetzt den Alphaherpesvirinae widmen und darunter dem Herpes-simplex-Virus, sieht man gleich, dass es zwei Familienmitglieder sind, die eine Rolle spielen. Es handelt sich um HSV-1 und HSV-2. Das Tierchen sieht an sich recht attraktiv aus, wenn es nicht krank machen würde. Es ist ein DNA-Virus, so wie alle Herpesviridae. Es ist behüllt. Es gibt zwei Familienmitglieder. Wir haben die Übertragung über Schmierinfektionen, klassisch über Speichel, sozusagen der berühmte Mutterkuss. Über Haut- und Schleimhautdefekte dringt das Virus ein, wandert retrograd zu den sensorischen Ganglien und bleibt dort ein Leben lang persistent. Es kann immer wieder reaktivieren, wenn das Immunsystem abgelenkt ist oder von uns wegtherapiert wurde. Die Durchseuchung für HSV-1 ist recht hoch. Das kennen wir. Der Herpes labialis ist eine klassische Volkskrankheit. HSV-2 ist tatsächlich nicht so häufig. Es ist ein bisschen abhängig von der Region und von den Lebensumständen. Man kann grob sagen, dass HSV-1 recht häufig und HSV-2 selten ist. Eine Erstinfektion wird meistens gar nicht wahrgenommen.
Die Patienten wissen nicht, dass sie Virusträger sind, bevor sie nicht die erste Reaktivierung in Form von Lippenbläschen hatten. Orolabiale Läsionen werden primär durch HSV-1 verursacht, HSV-2 verursacht vor allem Genitalinfektionen mit genitalen Ulzera. Nach der Transplantation, sei es HSZT oder SOT, reaktivieren die Patienten zuverlässig. Wenn sie Virusträger sind und keine Prophylaxe nehmen, bekommen 70 % bis 80 % der Patienten manifeste Läsionen, die der Reaktivierung geschuldet sind. Am häufigsten sind oropharyngeale Reaktivierungen. Das sieht man auch mal im Ösophagus. Es ist sehr schmerzhaft und hindert effizient am Essen. Es ist seltener im Genitalbereich. Unsere Patienten sind hochsuszeptibel, aber eine HSV-Enzephalitis ist interessanterweise relativ gesehen bei unseren Patienten nicht häufiger, wie bei Immunkompetenten.
Das bedeutet, es ist einer der Erreger, die man immer wieder findet. Ein entscheidender Punkt ist, dass die Serologie Ihnen nicht dabei hilft, festzustellen, ob eine aktive Virusreplikation vorliegt oder nicht. Dafür müssen Sie direkt das Genom nachweisen. Diese Bilder kennen wir leider bei unseren Patienten.
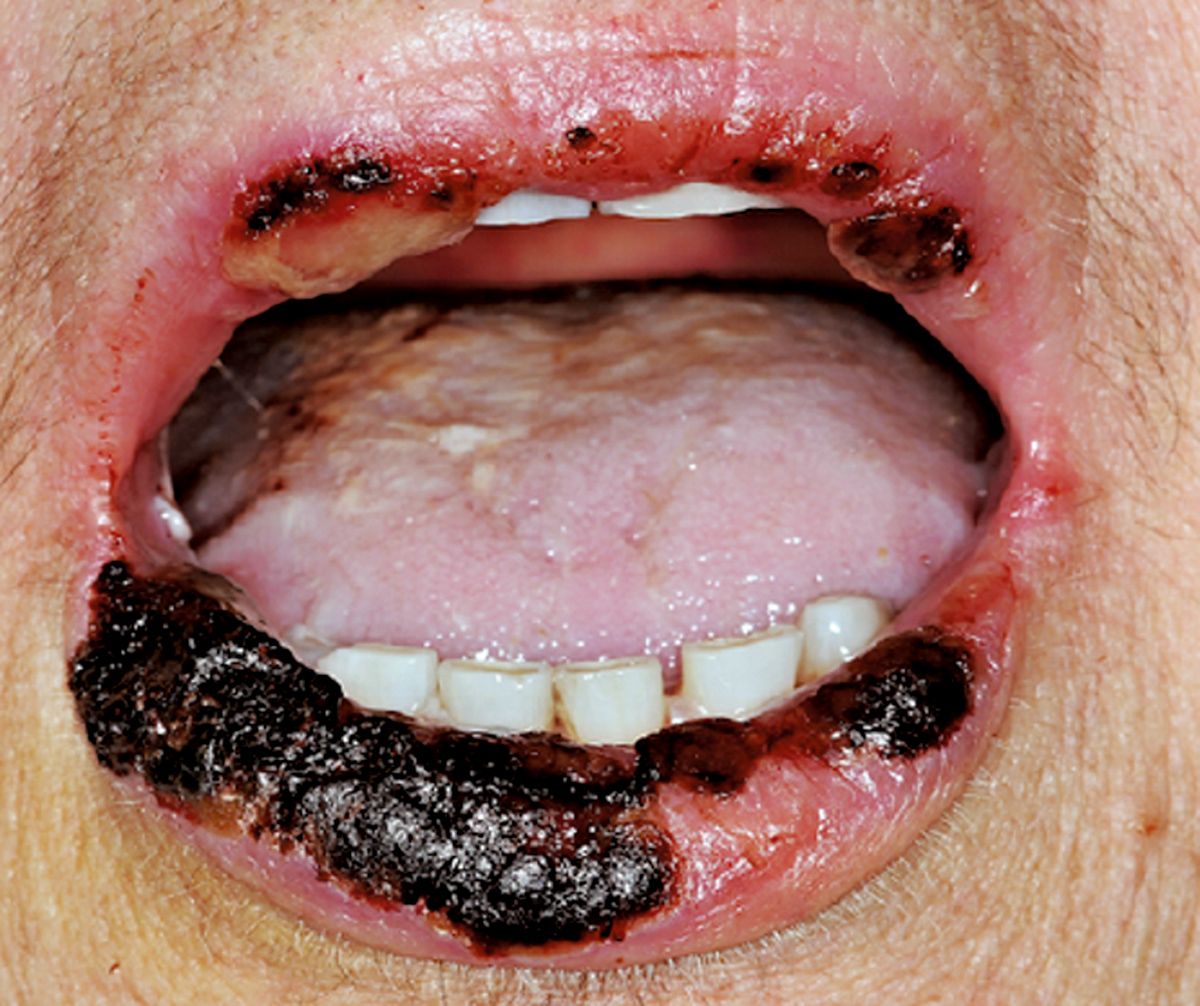
Orolabial, eine Virusreaktivierung, die Lippen und die Zunge sind betroffen. Häufig gibt es enoral sehr schmerzhafte Läsionen, wobei die Patienten einen sehr hohen Bedarf an Schmerzmedikation haben. Sie müssen parenteral ernährt werden, weil kauen und schlucken natürlich undenkbar ist. Man findet diese Herpesviren auch außerhalb von Mund-, Rachen- und Lippenbereich. Das ist ein Patient aus Würzburg mit einer kutanen HSV-1-Reaktivierung. Er hat eine sehr schmerzhaft Stelle am Steiß, wirklich sehr einschränkend für den Patienten. Es war darüber hinaus ein resistentes Virus, das wir mit i.v.-Medikamenten behandeln mussten, damit es ansatzweise weggegangen ist. Es ging dadurch in die richtige Richtung. Was heißt Vermeidung? Ich habe gesagt, dass das ein ganz entscheidender Punkt ist. Fast alle Patienten reaktivieren ohne Prophylaxe. Wir geben nach der Stammzelltransplantation tonnenweise Medikamente, um Infektionskomplikationen zu vermeiden. Es geht in dem Fall um die HSV- und VZV-Prophylaxe, weil es für beide Viren dasselbe Medikament gibt. Was wird empfohlen? Aciclovir, Valaciclovir oder Famciclovir. Sie können es eigentlich auswürfeln. Warum? Es gibt keine vergleichenden Studien. Es gibt keine Evidenz für die Dosis. Es gibt aus ökonomischen Gründen Argumente für das eine und gegen das andere. Der Standard ist sicherlich Aciclovir. Man kann es, wie man hier sieht, sowohl per os als auch i.v. geben.
Wichtig ist, dass sie eine HSV-Prophylaxe durchführen. Sie wird in der Regel das komplette erste Jahr, unter dem Aspekt, dass VZV damit abgedeckt wird, durchgeführt. Das ist wirklich wichtig. Das sollten Sie standardmäßig machen. Wenn es doch zu einer Reaktivierung, zu einer Ausbildung von Läsionen, zur Erkrankung kommt, geben Sie auch Aciclovir, aber in höheren Dosen. Wenn nur eine orale Manifestation vorliegt, ein wenig Schleimhaut betroffen, reichen 5 mg/kg, bitte drei Mal am Tag. Wenn es invasiver wird, Pneumonie oder Meningitis, geben Sie 10 mg/kg. Es muss ordentlich dosiert werden. Es gibt einen direkten Zusammenhang mit der Effektivität. Eine HSV-Pneumonie ist etwas, was man sehr selten sieht. Es macht mich immer ein wenig stutzig, dass man immer wieder HSV in der BAL findet, wenn wir Patienten auf der Intensivstation haben, die von uns transplantiert wurden, reaktivieren und Lavagen erhalten. Man findet auch immer mal CMV, wenn sie im Blut reaktiviert haben. Ich habe relativ lange geglaubt, dass das alles Bystander sind und dass es Tropismus ist. Stefan Hagel aus Jena hat das untersucht.
Er war ursprünglich derselben Meinung, nämlich dass es primär ein Begleitphänomen ist. Ich vermute, es war seine Intention, seinen Intensivmedizinern auszutreiben, immer Aciclovir zu verabreichen. Man muss sagen, dass es tatsächlich so ist, dass die Patienten davon profitieren, wenn man in solchen Situationen Aciclovir gibt.
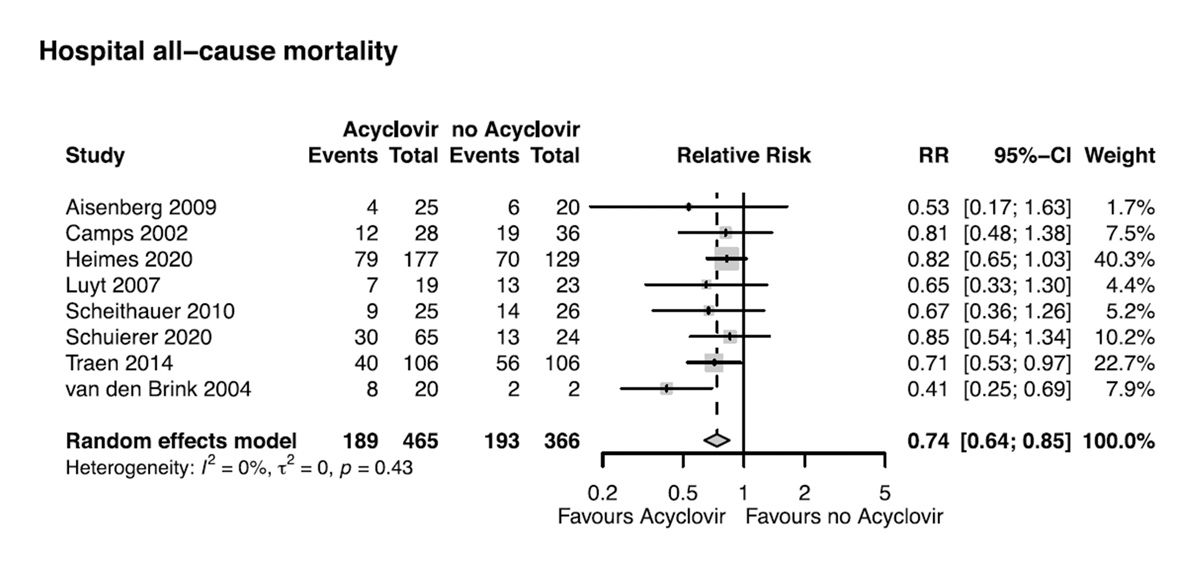
Abb. 2: Gesamtmortalität im Krankenhaus bei beatmeten Patienten mit HSV-Nachweis im Respirationstrakt [2]
Das heißt, es ist offensichtlich nicht so einfach, als dass man sagt, es ist der Nachweis einer Reaktivierung in dem infizierten Organ, sondern da gibt es Zusammenhänge. Wir können nachher gerne darüber diskutieren, wer Aciclovir gibt, wenn er HSV nachweist. Ich tue mir mit der Einschätzung ein wenig schwer. Wenn Resistenzen vorliegen, was tatsächlich gar nicht so selten ist, korreliert es sehr stark damit, wie häufig Sie danach schauen. In Würzburg ist es so, dass die Resistenztestung in der Virologie etabliert wird. Das bedeutet, dass es eigentlich standardmäßig praktisch fast immer getestet wird. Wir detektieren darüber sehr häufig Resistenzen. Es sind 5 % bis 15 % publiziert. Es sind in Würzburg gefühlt mehr. Ich glaube, es ist underreported, da insgesamt nicht konsequent getestet wird. Sie müssen Foscarnet oder Cidofovir geben. Wir haben bei dem Patienten mit der kutanen Läsion Foscarnet eingesetzt. Was haben wir in der Pipeline? Es gibt eine Substanz, die tatsächlich sehr vielversprechend ist. Das Pritelivir ist als Tablette verfügbar. Es ist explizit in der klinischen Prüfung für resistente HSV bei Immunkompromittierten. Spannend ist, dass die Firma, die das Medikament entwickelt hat, wir kennen sie von einem anderen Virusmedikament, ein Early Access Programm aufgelegt hat, da die Studie bislang überhaupt nur in zwei Zentren in Deutschland aktiv ist, bald in drei Zentren. Es ist schön, wenn man eine Möglichkeit hat, auch außerhalb der Studie an solche wertvollen Substanzen heranzukommen. Ich bedanke mich damit für die Aufmerksamkeit. Wir sammeln fleißig Fragen und würden im Anschluss an die Flashlights die Fragen gemeinsam diskutieren.
00:10:49
Überleitung
Prof. Dr. rer. nat. Martina Sester
Ich freue mich, Frau Dr. Eva Wagner-Drouet zu begrüßen. Sie ist Oberärztin der 3. medizinischen Klinik und Poliklinik des Uniklinikums Mainz. Sie leitet dort das Zentrum für zelluläre Immuntherapie und Stammzelltransplantation. Sie wird uns, ähnlich wie gerade Herr Dr. Teschner, einen Impulsvortrag zu dem Thema VZV geben.
00:11:17
VZV nach allogener HSZT
Dr. med. Eva Maria Wagner-Drouet
Herzlichen Dank und ein Hallo an alle vor den Bildschirmen. Ich würde direkt mit einem klinischen Fall starten wollen. Mein Tagesgeschäft ist die allogene Stammzelltransplantation. Wir haben eine Leukämiepatientin transplantiert. Es war ein HLA-identer Fremdspender. Alle Herpesviren waren sowohl beim Empfänger als auch beim Spender positiv. Diese Patientin hatte einen Nachweis einer minimalen Resterkrankung. Wir haben deshalb mit Spender-Lymphozyten an einem Boost des Immunsystems gearbeitet, um die Erkrankung wirklich zu vernichten. Es ist eine häufige Nebenwirkung bei dieser Immunstimulation, dass das Immunsystem überschießend reagiert und eine GvHD, eine Graft-versus-Host-Erkrankung auftritt. Das ist eine Reaktion des Spender-Immunsystems gegen gesundes Patientengewebe. Das wird mit Immununterdrückung behandelt. Das Standardmedikament ist Cortison. Diese Patientin hat zusätzlich eine zweite Therapielinie, die Ruxolitinib, einen JAK-Inhibitor, benötigt. Es ist eine tiefe Immunsuppression. Diese Patientin hatte bei ihrer GvHD eine schwere Darmbeteiligung mit Durchfällen und Schmerzen. Wir hatten eigentlich das Gefühl, dass wir mit unserer immunsuppressiven Therapie die GvHD sehr gut kontrolliert haben. Sie stellte sich plötzlich in der Notaufnahme mit stärksten Bauschmerzen vor. Sie brauchte Opiate, um die Schmerzen zu kontrollieren. Wir haben in der Diagnostik im CT eigentlich nichts Neues gefunden. Wir kannten die Entzündung des Darms bereits. Wir haben keinen Erreger von Durchfallerkrankungen in den Stuhlproben gefunden. Wir haben aber gesehen, dass die VZV-PCR im Blut stark erhöht war. Wir haben in der Endoskopie, in der Darmspiegelung, verschiedenste tiefste Ulzerationen im Darm gefunden. Der Pathologe konnte uns bestätigen, dass wir neben der uns bereits bekannten GvHD, die im Begriff war abzuheilen, jetzt auch VZV in den Läsionen finden. Das konnte sowohl mit einer Immunhistochemie und auch molekularpathologisch nachgewiesen werden.
Das ist leider etwas, was wir zwar selten, aber durchaus bei unseren stammzelltransplantierten Patienten sehen. Wie Herr Teschner erwähnte, gehört VZV zur Gruppe der Herpesviren. Wir haben zwei verschiedene Manifestationsformen. Es gibt zum einen die exogene Erstmanifestation, die klassischen Windpocken, die Varizellen, die vor der Impfung hauptsächlich bereits im Kindesalter erworben werden. Sie sind extrem ansteckend, nicht nur der Bläscheninhalt, sondern auch Speichel, Husten oder Tränenflüssigkeit. Seit 2004 und seit der verschärften Impfempfehlung etwas später gibt es einen deutlichen Rückgang der tatsächlichen Erstmanifestation der Windpocken.
Das, was wir bei unseren Pateinten nach der Transplantation häufig sehen, ist die Reaktivierung. Das ist die klassische Gürtelrose, die wir in der Bevölkerung bei älteren Patienten sehen. Wir haben gerade bei den älteren Patienten eine Häufung. Jeder Zweite über 80 Jahre hatte eigentlich schon eine Gürtelrose. Das klinische Bild der Varizellen ist relativ unspezifisch. Am Anfang beginnt es mit Kopf- und Gliederschmerzen, Fieber und einem juckenden Exanthem, bis sich diese typischen Papeln ausbilden, die verschorfen. Es ist dieses Sternhimmelbild. Das Gefährliche daran trifft genau unsere Patienten. Wir haben bakterielle Superinfektionen, gerade bei erwachsenen Patienten kann sich eine VZV-Pneumonie ausbilden und das zentrale Nervensystem kann in vielfältiger Weise beteiligt sein. Myokarditis, Glomerulonephritis und Hepatitis sind sicherlich eher seltenere Manifestationen. Das Bild des Herpes zoster bei den an sich Immungesunden beschränkt sich eher auf ein Dermatom. Wir wissen, dass geimpfte Patienten deutlich seltener eine Reaktivierung ausbilden als ungeimpfte Patienten. Kinder zeigen einen eher milden Verlauf.
Wir sehen bei unseren immunsupprimierten Patienten häufig disseminierte Krankheitsbilder, also eine Verteilung über mehrere Dermatome. Wir sehen hier häufig eher atypische ZNS-Manifestationen wie Meningoenzephalitiden, Angitiden oder die aufsteigende Myelitis und, wie bei unserer Patientin im Fallbeispiel, die viszerale Manifestation.
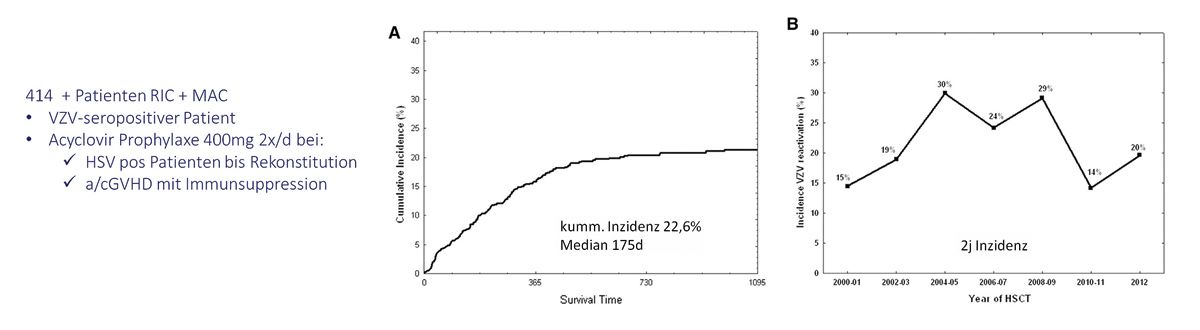
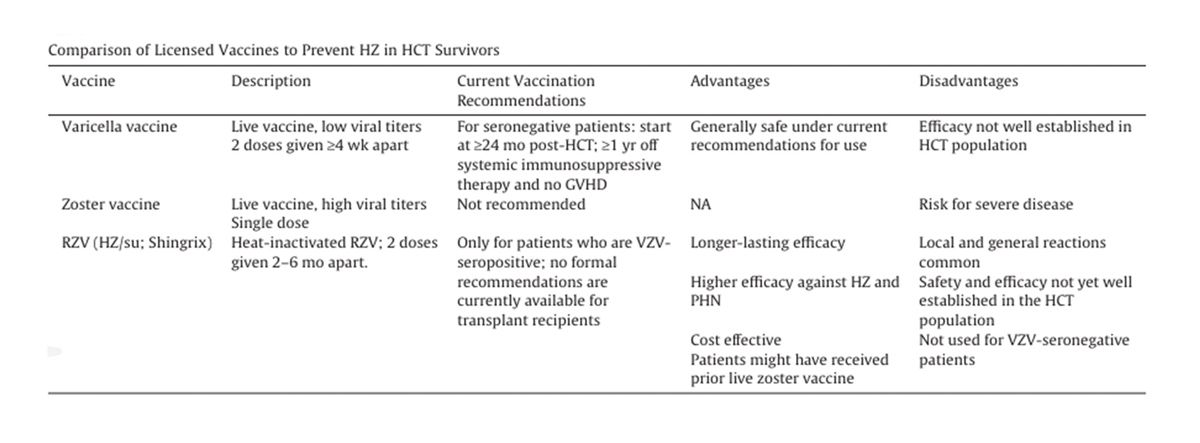
Es gibt seit 2004 eine Impfempfehlung der STIKO. Im Prinzip sollte jedes Kind ab 11 Monaten geimpft werden, seit 2004 zweimal. Gerade Patienten, bei denen wir eine immunsuppressive Therapie planen, das kann eine Transplantation sein, das kann eine andere immunsuppressive Therapie bei beispielsweise einer Autoimmunerkrankung sein, sollten seronegative Patienten geimpft werden. Das Personal im Gesundheitsdienst, wenn es seronegativ ist, sollte geimpft sein. Es gibt zusätzlich eine Impfempfehlung für seropositive Patienten, die älter sind, ab 60 Jahren, und bei 50-jährigen Patienten, die zusätzlich Immundefizienzen aufweisen, um die Reaktivierung des VZV zu verhindern. Wir haben in Deutschland seit 2020 die Zulassung ab 18 Jahre, aber hierzu gibt es aktuell keine STIKO-Empfehlung. Was konnten wir durch die Impfung erreichen? Das sind etwas ältere Daten aus dem Jahr 2020. Wir sehen tatsächlich relativ wenige VZV-Erstinfektionen. Die Infektionen, die wir sehen, sind Cluster-Infektionen hauptsächlich im ungeimpften Kinderkollektiv. Wie sieht es nach der hämatopoetischen Stammzelltransplantation aus? Wir sehen bis zu 50 % VZV-Reaktivierungen. Die Hauptrisikofaktoren sind medizinische Eingriffe, welche die T-Zellimmunität schwächen. Das kann unsere Art zu transplantieren sein. Das kann eine Graft-versus-Host-Erkrankung oder eine sekundäre Immunsuppression sein. Hier ist, wie bereits durch Herrn Teschner erwähnt, die Aciclovir-Prophylaxe empfohlen und sehr effektiv. Es ist unklar, auch im internationalen Standard, wie lange und in welcher Dosierung man sie fortführen sollte. Das ist eine Arbeit, in der tatsächlich sehr konsequent nur während der Frühphase der Transplantation oder bei sekundären Immunsuppressionen Aciclovir gegeben wird.
Wir sehen hier, dass innerhalb des ersten Jahres trotzdem 20 % der Patienten mit VZV reaktivieren. Die Therapieoptionen sind die gleichen, die Herr Teschner bereits erwähnt hat. Es ist mir wichtig, erneut zu betonen, dass gerade Aciclovir per os nicht sehr gut bioverfügbar ist. Man muss hier wirklich sehr hoch und ausreichend lange therapieren. Bei i.v.-Gabe ist die Bioverfügbarkeit sehr gut. Wir haben bei Famciclovir in Deutschland ein kleines Kostenübernahmeproblem. Es ist jedoch sicherlich ein sehr effektives Medikament. Was unsere Patienten nach der Reaktivierung besonders in der Lebensqualität einschränkt und uns therapeutisch herausfordert, ist sicherlich die Post-Zoster-Neuralgie, die bei Immungesunden ungefähr 15 % beträgt. Sobald wir in das ältere Kollektiv oder in die immunkompromittierten Patienten gehen, betrifft es mehr als die Hälfte der Patienten. Wir müssen direkt am Anfang der Reaktivierung eine sehr konsequente Schmerztherapie durchführen. Es gibt zunehmend Daten darüber, dass Hyperimmunglobuline, das ist die passive Immunisierung, positive Effekte für die Post-Zoster-Neuralgie hat. Die Studiendaten, die ich Ihnen zeigen möchte, umfassen Patienten, die Aciclovir zur Therapie und das Immunglobulin zusätzlich bekommen haben.
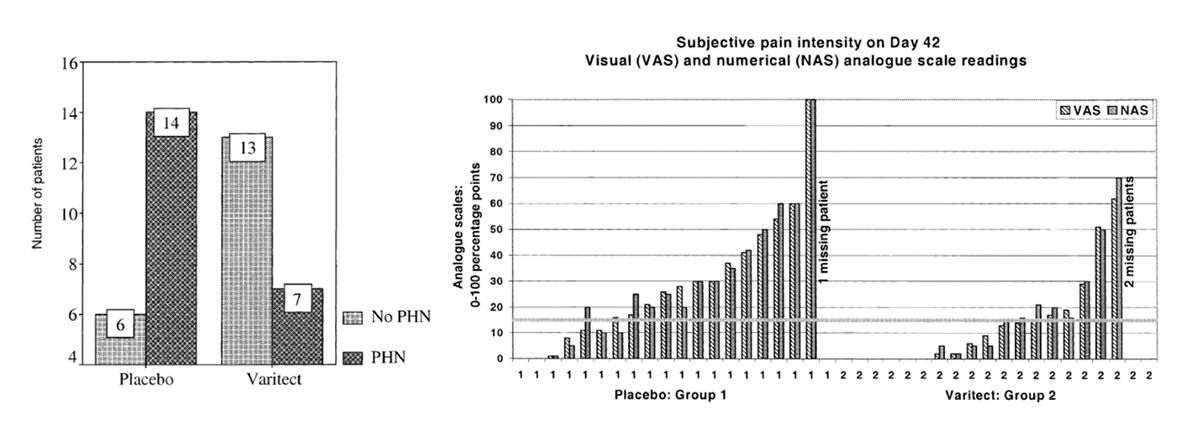
Abb. 4: Inzidenz und Schmerzintensität Post-Zoster-Neuralgie Aciclovir + VZV-IG vs. Aciclovir + Placebo [4]
Wir sehen eine Reduktion der Häufigkeit und der Schwere der Post-Zoster-Neuralgie. Es ist wichtig, es früh einzusetzen, wenn man es einsetzt. Man setzt es möglichst innerhalb der ersten 48 bis 72 Stunden ein. Das RKI empfiehlt diese passive Immunisierung insbesondere als Postexpositionsprophylaxe für ungeimpfte Schwangere, Neugeborene und Frühgeborene, aber auch für unsere immunsupprimierten Patienten. Dies ist eine Übersichtarbeit von unter anderem Per Ljungman. Sie ist aus dem Jahr 2018, schon etwas älter, aber es hat sich nicht viel daran geändert.
Wir können demnach neben der antiviralen Aciclovir-Prophylaxe verschiedene Impfstrategien in der Transplantiertenkohorte anwenden. Die Daten, die es dazu gibt, sind meistens gemischt, autologe und allogene Stammzelltransplantationen. Wir haben die Möglichkeit, Lebendimpfungen einzusetzen. Das können wir vor Start der Immunsuppression oder nach der Transplantation durchführen. Wir müssen aber einen ausreichenden Abstand zur Transplantation und GvHD einhalten. Die Daten zur Möglichkeit, eher attenuierte oder Totimpfstoffe zu verwenden, zeigen, dass wir eine sehr gute Verbesserung der Immunantwort erreichen. Für die rekombinante Impfung gibt es mittlerweile Daten, dass wir mit repetitiven Impfstrategien sehr gute Immunantworten in Monat vier nach der Transplantation erreichen können. So ist zumindest die Empfehlung in der Community, früh nach der Transplantation nicht die Lebend-, sondern die Totimpfstoffe einzusetzen. Erst wenn wir dort eine entsprechende Impfantwort feststellen können, setzen wir die Prophylaxe an. Das findet sich leider nicht in den Empfehlungen der STIKO wieder. Ich habe hier die STIKO-Empfehlungen aufgeführt. Das ist das, was leider für die Kostenübernahme wichtig ist. Sie finden das auch in den entsprechenden Impfkalendern der STIKO. Was leider auch heute, 2024, immer noch so bleibt, ist, dass wir Aciclovir-Prophylaxen empfehlen, dass die Dauer der Prophylaxe etwas unklar ist und dass wir uns bessere Impfstrategien in der Empfehlung wünschen. Vielen Dank.
00:21:54
Überleitung
Prof. Dr. rer. nat. Martina Sester
Vielen herzlichen Dank, Frau Wagner-Drouet, für den schönen Übersichtsvortrag zum Thema VZV. Wir fahren jetzt fort mit dem nächsten Vortrag. Es geht um EBV und das Posttransplantationslymphom, eine sehr relevante Komplikation nach Transplantationen. Wir haben hier unter uns Frau Prof. Dr. Inken Hilgendorf. Sie ist Oberärztin der Abteilung für Hämatologie und internistische Onkologie am Universitätsklinikum Jena und ist dort Sektionsleiterin für Stammzelltransplantation. Frau Hilgendorf, auch ich freue mich auf Ihren Vortrag.
00:22:31
Virusinfektionen post-Tx – Flashlight EBV
Prof. Dr. med. Inken Hilgendorf
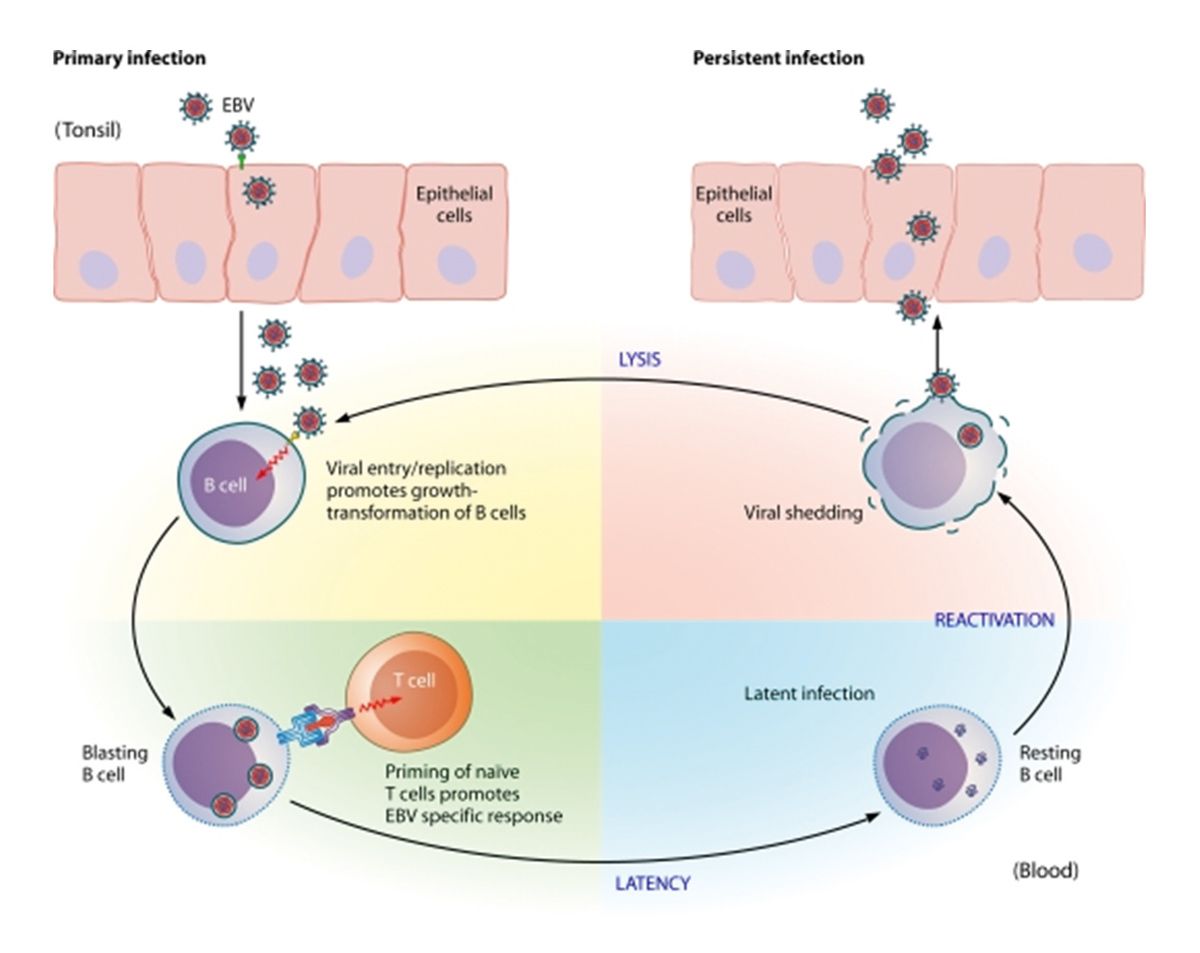
Vielen Dank für die einführenden Worte. Ein herzliches Hallo auch von mir an die Bild- schirme und an alle, die uns gespannt zuhören. Hier ist ganz kurz die Offenlegung meiner Interessenskonflikte, die keinen Einfluss auf den Vortrag haben sollten. Das Epstein-Barr-Virus feiert dieses Jahr seinen 60. Geburtstag. Es wurde 1964 von Herrn Epstein und Herrn Barr in kultivierten Lymphoblasten eines Patienten mit Burkitt-Lymphom beschrieben. Sie sehen hier sehr schön die Zellmembran, das endoplasmatische Retikulum und hier oben die Viruspartikel. Ich sage ganz kurz etwas zur Pathogenese des Epstein-Barr-Virus und der Epstein-Barr-Virusinfektion.
Die B-Zellen sind das Target. Das Virus geht in die B-Zellen. Es kommt zu einer Virusreplikation, zu einer Transformation der B-Zellen und dann im Prinzip zu dieser blastealen Veränderung. Die Viruspartikel werden auf der Zelloberfläche präsentiert und es kommt zu einem Priming von naiven T-Zellen, die in der Lage sind, die Virusinfektion zu kontrollieren. Wir wissen heutzutage andererseits, dass es eine latente Infektion gibt. Gerade in Situationen, in denen wir das Immunsystem unterdrücken, wie beispielsweise nach der Organtransplantation oder nach der Stammzelltransplantation, kann es zu einer unkontrollierten Proliferation der EBV-positiven B-Zellen kommen.
Zudem muss man berücksichtigen, dass die Durchseuchungsrate mit EBV in der Gesellschaft sehr, sehr hoch ist. Sie liegt bei 90 % bis zu 95 %. Wir haben es mit einer relativ langen Inkubationszeit zu tun. Es handelt sich um 32 bis 49 Tagen vom Kuss bis zum Symptom. Das habe ich so geschrieben, da es häufig als Kusskrankheit oder Pfeiffersches Drüsenfieber beschrieben wird. Man muss zudem sagen, dass es Unterschiede hinsichtlich der EBV-positiven Posttransplantations-lymphoproliferativen Erkrankung gibt. Es ist bei der Organtransplantation häufig so, dass die EBV-Fälle eher vom Empfänger stammen, während hingegen wir bei der Stammzelltransplantation häufiger von spenderassoziierten PTLDs reden. Was macht man präventiv?
Das „A“ und „O“ ist sicherlich das Monitoring der Patienten, indem man regelmäßig die EBV-DNA bestimmt. Man muss ganz klar sagen, dass der Cut-off-Wert für die Einleitung einer präemptiven Therapie sehr, sehr umstritten ist. Häufig wird ein Cut-off-Wert von ≥ 10.000 Genomkopien/ml im Serum gewählt. Eine andere Definition, ein anderer Cut-off-Wert ist, wenn man zwei Mal hintereinander über 1.000 Genomkopien nachweisen kann. Auch das könnte zur Einleitung einer präemptiven Therapie führen. Man kann außerdem versuchen, die Immunsuppression so gering wie nur irgend möglich zu fahren, weil auch das dazu führt, dass das Risiko des Auftretens einer EBV-positiven PTLD sinkt. Des Weiteren ist prophylaktisch durchaus der Einsatz von Rituximab oder alternativ präemptiv empfohlen. Man weiß, dass das Virus logischerweise dann weniger Angriffsfläche hat, wenn man die B-Zellen depletiert, also das Target wegnimmt.
Die Klinik einer EBV-Reaktivierung ist sehr, sehr variabel. Sie ist häufig durchaus unspezifisch, im Sinne von, dass die Patienten Fieberschübe oder manchmal einfach eine B-Symptomatik aufweisen können. Es kann mit Nachtschweiß und mit Gewichtsverlust einhergehen. Es fällt manchmal zusätzlich eine Lethargie auf oder es können gastrointestinale Symptome auftreten. Ganz klassisch ist, wie auch bei der Primärinfektion, letztendlich die Lymphadenopathie, die vergrößerten Tonsillen. Wir sehen manchmal eine Zytopenie, die auftreten kann, oder auch eine Hepatosplenomegalie. Es kann zusätzlich zu einer neurologischen Mitbeteiligung kommen, indem die Patienten über Kopfschmerzen klagen oder wir sogar fokal neurologische Defizite beobachten. Was macht man diagnostisch? Wir bestimmen die EBV-Viruslast. Es ist sicherlich sinnvoll, ein Blutbild zu machen. Ich hatte gesagt, es kann durchaus eine Panzytopenie auftreten. Es gibt darüber hinaus zusätzliche Parameter aus der klinischen Chemie, beispielsweise die Bestimmung der Laktatdehydrogenase, die zeigen, ob wir es mit einem erhöhten Zellumsatz zu tun haben. Wenn der Verdacht naheliegt, dass beispielsweise eine Lymphoproliferation aufgetreten ist, sollte man eine FDG-PET durchführen. Wenn das nicht zur Verfügung steht, wäre die Alternative, im Prinzip mit einer CT von Hals, Thorax, Abdomen und der Beckenorgane einmal komplett durchzustagen. Wenn die Patienten neurologische Symptome zeigen oder über Kopfschmerzen klagen, sollte zusätzlich eine MRT des Kopfes und gegebenenfalls eine Liquorpunktion durchgeführt werden. Das „A“ und „O“ ist die histologische Sicherung, indem man eine Lymphknotenentnahme und gegebenenfalls eine Knochenmarktpunktion durchführt. Man sollte daran denken, dass es durchaus zu einer extranodalen Beteiligung, insbesondere des Gastrointestinaltrakts, kommen kann. Das macht ungefähr 29 % aus. Es kann zu einer Beteiligung des zentralen Nervensystems kommen. Es gibt unterschiedliche Angaben dazu. Die liegen zwischen 2 % bis 15 %. Wenn wir eine Histologie gewonnen haben, kann man es in vier große Gruppen einteilen.
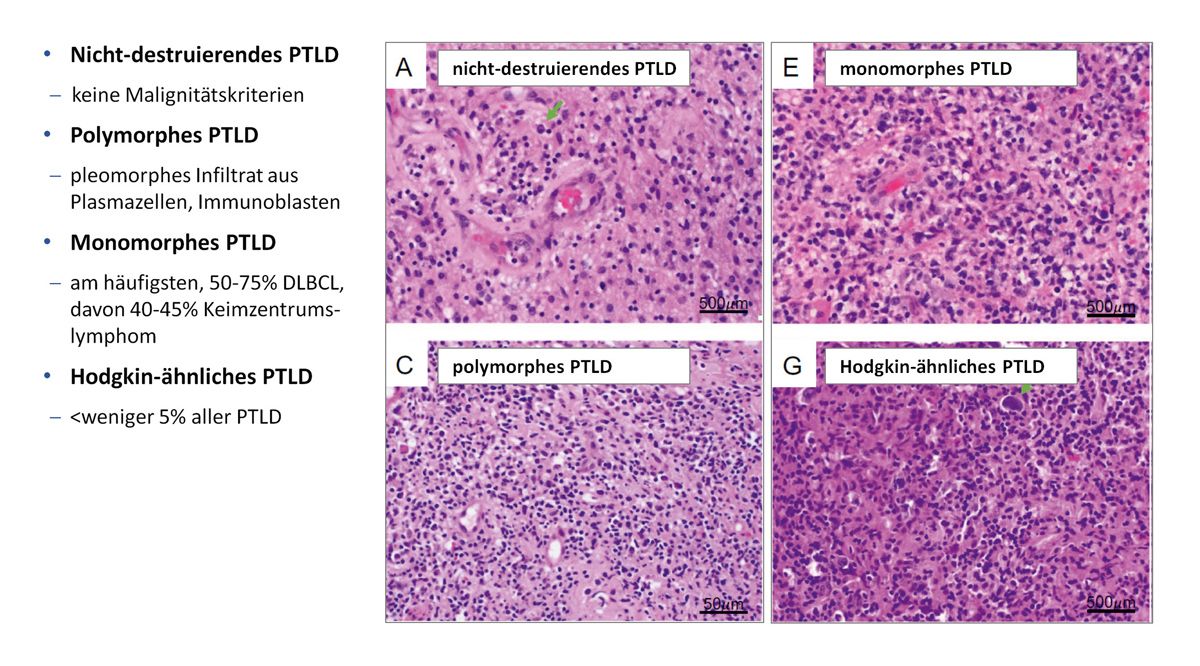
Es sind zum einen die nicht-destruktiven PTLDs, die nicht maligne sind. Man sollte sie von den Polymorphen, wo wir häufiger Immunoblasten, Plasmazellen, sehen, und den Monomorphen abgrenzen. Das führende Bild ist eigentlich das diffus großzellige Lymphom.
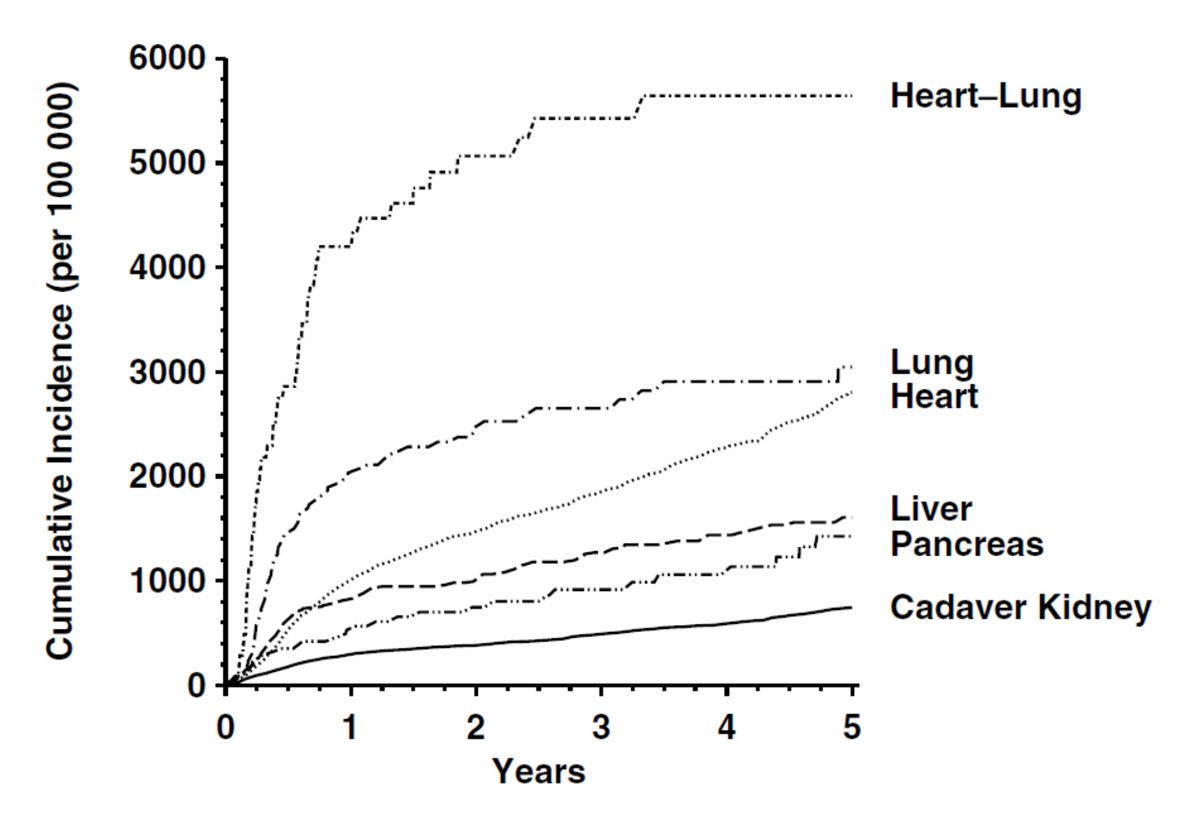
Davon wiederum sind 40 % bis 45 % Keimzentrumslymphome. Eher selten sind die Hodgkin-ähnlichen PTLDs, die an die Histologie bei einem Morbus Hodgkin erinnern. Das macht weniger als 5 % aus. Ich komme damit zum EBV-PTLD bei der Organtransplantation. Die Inzidenz liegt bei rund 20 % aller auftretenden Zweitmalignome. Wir wissen, dass es durchaus einen Unterschied macht, welches Organ transplantiert worden ist.
Insbesondere nach einer Herz-Lungen-Transplantation ist das Risiko viel, viel höher als beispielsweise nach einer Nierentransplantation. Man muss dabei natürlich sagen, dass man bei einer Nierentransplantation die Immunsuppression sicherlich ein bisschen mehr herunternehmen kann, als man es bei einer Herz-Lungen-Transplantation tun würde. Im Median tritt ein EBV-positives PTLD nach fünf Jahren auf, wobei das Risiko sicherlich im ersten Jahr am höchsten ist. Wenn die Patienten auf die Therapie nicht ansprechen, sprechen wir leider über eine sehr hohe Mortalität von 30 % bis 60 %. Bei der Stammzelltransplantation hingehen ist die Inzidenz niedriger. Sie liegt bei 0,5 % bis 17 %. Wir sehen die Reaktivierung häufiger und reagieren frühzeitig darauf. Der Zeitpunkt des Auftretens liegt zwischen sechs bis zwölf Monaten nach der Transplantation. Wir kennen viele unterschiedliche Risikofaktoren, wie das Patientenalter über 50 Jahren. Wir wissen, dass die CMV-Reaktivierung, über die wir nachher noch sprechen werden, einen Risikofaktor darstellen kann.
Weitere Risikofaktoren sind, wie vorhin erwähnt, die T-Zelldepletion, HLA-Mismatch, Transplantation oder die GvHD. Was man tun kann und was wir immer versuchen zu tun, ist die Reduzierung der Immunsuppression durch den zusätzlichen Einsatz von Rituximab. Wir haben damit relativ hohe Remissionsraten. Ich sage ganz kurz etwas zu den Therapieoptionen. Man sollte die Immunsuppression reduzieren. Wir verabreichen Rituximab gegebenenfalls in Kombination mit einer Chemotherapie wie dem CHOP-Protokoll. Man kann zusätzlich unselektionierte DLIs oder Blinatumomab geben. Relativ neu ist der Einsatz von EBV-spezifischen T-Zellen, den Tabelecleucel.
T-Zell-Immuntherapie.
Man muss hier jedoch ganz klar sagen, dass insbesondere bei Patienten mit GvHD eine geringere Effektivität beschrieben wird. Es gibt viele weitere Therapieoptionen, die hier aufgeführt sind, die aber häufig nur auf Einzelfallberichten oder kleinen Case-Series beruhen. Zusammenfassend ist zu sagen, wir haben eine hohe Durchseuchungsrate in der Bevölkerung. Sie liegt bei 90 % bis 95 %. Wir wissen, dass es zu einer latenten EBV-Infektion kommen kann. Wichtig ist das Monitoring der EBV-Viruslast. Wenn die Patienten auf die Initialtherapie nicht ansprechen, haben wir es leider mit einer sehr, sehr hohen Mortalität zu tun. Ich danke Ihnen damit an dieser Stelle für Ihre Aufmerksamkeit. Ich denke, wir machen gleich weiter mit den Fragen und Antworten.
00:33:34
Q & A
Prof. Dr. rer. nat. Martina Sester
Vielen Dank an Sie, Frau Hilgendorf, für den spannenden Vortrag. Kommen Sie jetzt in unsere Mitte. Wir fahren fort mit der Diskussion. Ich sehe schon eine Frage im Chat. Sie dürfen gerne weitere Fragen an unsere Expertinnen und Experten adressieren. Es kam eine Frage zu der VZV-Impfung. Vor dem Hintergrund, dass so viele Infektionen in der Frühphase nach Transplantationen kommen, warum wird erst so spät geimpft? Das war eine Frage.
Dr. med. Eva Maria Wagner-Drouet
Ich stelle ganz kurz klar, dass es meistens keine neuen Infektionen sind. Die meisten Patienten waren schon in früher Jugend infiziert. Das heißt, wir sprechen über die Reaktivierung, also über die Gürtelrose. Das Hauptproblem ist, dass das, was durch die STIKO empfohlen und damit von der Kostenübernahme gedeckt wird, leider nur die Lebendimpfstoffe sind. Wenn wir Patienten sehr früh nach einer Transplantation oder unter Immunsuppression mit einem Lebendimpfstoff impfen, haben wir die Sorge, dass wir die Situation verschlechtern und der Patient eine Impferkrankung bekommt. Das ist eigentlich im Moment das Hauptproblem. Es gibt zunehmend Daten zu den Totimpfstoffen oder attenuierten Lebendimpfstoffen, die darauf hinweisen, dass dieses Konzept sicherer sei und man es früher nach der Transplantation einsetzen kann. Wir tun das durchaus, aber immer nach Einzelfall-Kostenübernahmeanfrage, was natürlich sehr aufwendig ist. Ich denke jedoch, es wird in Zukunft hoffentlich in diese Richtung gehen. Ich glaube daran, dass die STIKO ihre Empfehlung vielleicht doch noch ausspricht.
Prof. Dr. rer. nat. Martina Sester
Ich habe gerade dazu eine Frage. Der Totimpfstoff ist doch ab 50 Jahren bei Immunsupprimierten empfohlen oder sind Stammzelltransplantierte ausgenommen?
Dr. med. Eva Maria Wagner-Drouet
Die sind nicht explizit erwähnt.
Prof. Dr. med. Christina T. Rieger
Ich kann ganz kurz etwas dazu sagen. Das ist ganz genau die wichtigste Information. Bei über 50-Jährigen ist die Kostenerstattung inzwischen vollständig gewährleistet. Es geht vor allen Dingen um die unter 50-jährigen stammzelltransplantierten Patientinnen und Patienten. Es wird als Standardimpfung von der STIKO ab über 60 Jahren empfohlen. Da sind natürlich alle über 60-jährigen immunsupprimierten Patientinnen und Patienten inkludiert. Mit Vorliegen einer immunsuppressiven Therapie ist ab dem 50. Lebensjahr die Kostenerstattung gewährleistet. Man muss gar nicht mehr unbedingt bei der Krankenkasse anfragen. Die Erstattung ist klar, wenn eine Immunsuppression vorliegt. Die STIKO hat sich dazu noch nicht geäußert. Wir wissen aber, dass es ein Anschlusspapier geben wird. Unsere Fachgesellschaft hat dazu eine Empfehlung erarbeitet. Die reicht im Grunde für die Kostenerstattung. Es sollte zumindest seit 2021 keine unangenehmen Rückfragen mehr geben.
Prof. Dr. rer. nat. Martina Sester
Vielen Dank, Frau Rieger. Ich hätte jetzt eine Frage zum Thema HSV an Herrn Teschner. Sind Risikofaktoren für die Entwicklung von Resistenzen für das Aciclovir bekannt?
Dr. med. Daniel Teschner
Man muss sagen, vom Prinzip her wird man davon ausgehen, wie Erfahrungen mit anderen Viren zeigen. Die Wahrscheinlichkeit für eine Resistenzentwicklung ist höher, wenn man beispielsweise subtherapeutisch prophylaxt. Es gibt dazu keine systematischen Untersuchungen. Ich habe ja gesagt, die Prophylaxe wird sehr heterogen gehandhabt. Man müsste es sich tatsächlich einmal prospektiv anschauen. Es ist wahrscheinlich ein Problem der grenzwertig subtherapeutischen Prophylaxe mit Aciclovir. Es kommt daraufhin zu diesen Resistenzinduktionen. Der entscheidende Punkt ist zu versuchen, regelmäßig danach zu schauen. Wenn man am Ort oder in Kooperation mit dem Labor die Möglichkeit hat, niederschwellig zu schauen, findet man deutlich mehr, als man klinisch eigentlich erwarten würde. Es sei dahingestellt, ob das immer eine Konsequenz hat. Ich glaube jedoch, diese 5 % bis 15 % sind zu wenig.
Prof. Dr. rer. nat. Martina Sester
Vielen Dank. Die folgende Frage gilt für Sie alle drei. Es sind drei Erreger, die sehr häufig hochprävalent sind. Machen Sie vor Transplantationen eine Serotestung von Spendern und Empfängern? Ich sehe ein Nicken von allen. Bei HSV wird auch getestet?
Dr. med. Daniel Teschner
Das ist Standard.
Prof. Dr. rer. nat. Martina Sester
Es ist Standard vor dem Hintergrund, dass man generell ohnehin eine Prophylaxe macht?
Dr. med. Daniel Teschner
Die Idee ist letztendlich, dass man das Reaktivierungspotenzial erfassen möchte, ähnlich wie bei CMV. Für HSV, VZV ist es genauso wichtig. Man findet tatsächlich immer mal wieder Patienten, die beides nicht gesehen haben. Das ist nicht häufig, aber man findet es ab und zu. Da könnte man sich theoretisch die Prophylaxe sparen. Man sollte auf jeden Fall danach schauen. Es ist letztendlich auch gesetzliche Vorgabe.
Prof. Dr. rer. nat. Martina Sester
Vielen Dank. Ich hätte eine Frage an Frau Hilgendorf. Sie erwähnten die Bedeutung des Monitorings. Wie lange und wie häufig sollte man bei Stammzelltransplantierten ein Monitoring machen?
Prof. Dr. med. Inken Hilgendorf
Wir machen tatsächlich wöchentlich ein Monitoring und zwar so lange, wie wir mit immunsuppressiver Therapie bei Stammzelltransplantierten drin sind. Wir machen das in der Regel mindestens das erste halbe Jahr.
00:39:06
Überleitung Spotlight r/r CMV-Infektion nach Tx
Prof. Dr. rer. nat. Martina Sester
Vielen Dank. Wir werden uns jetzt einem weiteren wichtigen Erreger nach der Transplantation zuwenden. Es ist ebenfalls ein Herpesvirus, ähnlich wie die drei, die wir gerade gehört haben. Es ist ein persistierendes Virus, was einmal infiziert nie mehr aus unserem Körper eliminiert wird und unser Immunsystem sehr stark beansprucht. Vor diesem Hintergrund wundert es natürlich nicht, dass bei Immunsuppression auch dieses Virus, das Cytomegalievirus, für erhebliche Komplikationen sorgt. Wir haben hier bei uns zwei Experten. Herrn Dr. Teschner, den Sie gerade schon gesehen haben, und Prof. Oliver Witzke. Er ist Direktor der Klinik für Infektiologie des Uniklinikums Essen. Gemeinsam mit den beiden werden wir Ihnen ein Schlaglicht auf die CMV-Infektion, das Management und insbesondere auf die resistenten und refraktären CMV-Infektionen geben. Das ist eine besondere Herausforderung, die wir trotz sehr gut standardisierter Behandlung nach wie vor haben. Ich freue mich auf dieses Modul. Ich möchte die Vortragsserie mit Oliver Witzke eröffnen, der uns zu Beginn ein paar Stichworte zu dem Virus geben wird. Das Thema wird nach und nach vertieft aus Sicht der soliden Organ- und Stammzelltransplantation.
00:40:37
Neues zu Infektionen nach Organtransplantation Teil 1
Prof. Dr. med. Oliver Witzke
Vielen Dank für die Einladung. Ich glaube, es ist das Virus, das uns Transplanteuren insgesamt die meisten Probleme bereitet. Die Interessenskonflikte werden hier gezeigt. Ich möchte Ihnen dieses Virus gerne vorstellen.
Die Seroprävalenz des CMV-Virus, ein ebenfalls großes DNA-Virus, ist weltweit sehr, sehr unterschiedlich. In Deutschland haben wir die Situation, dass etwas mehr als die Hälfte der Menschen positiv ist. Es gibt eine lebenslange Persistenz. Es ist weltweit ganz anders. Es hängt von sozioökonomischen Standards wie Familiengröße, Herkunftsland und dem Alter ab. In Deutschland kann sehr oft die Situation eintreten, dass im Kontext einer Transplantation eine Neuinfektion auftritt. Es liegen somit eine Neuinfektion und eine Reaktivierung vor. Wir sehen hier die Wege der Virusübertragung. Es wird übertragen durch Blut, Körperflüssigkeiten, im Rahmen von Transplantationsereignissen und auf natürlichem Weg.
Die Übertragung von Mutter auf Kind während der Geburt über die Plazenta ist eine klinisch sehr relevante Sache, die heute nicht unser Thema wird, die aber vielleicht unterschätzt wird. Sie kann für das Kind zu schweren Problemen führen. Wie bewerten wir das im Rahmen der Situation der Transplantation?
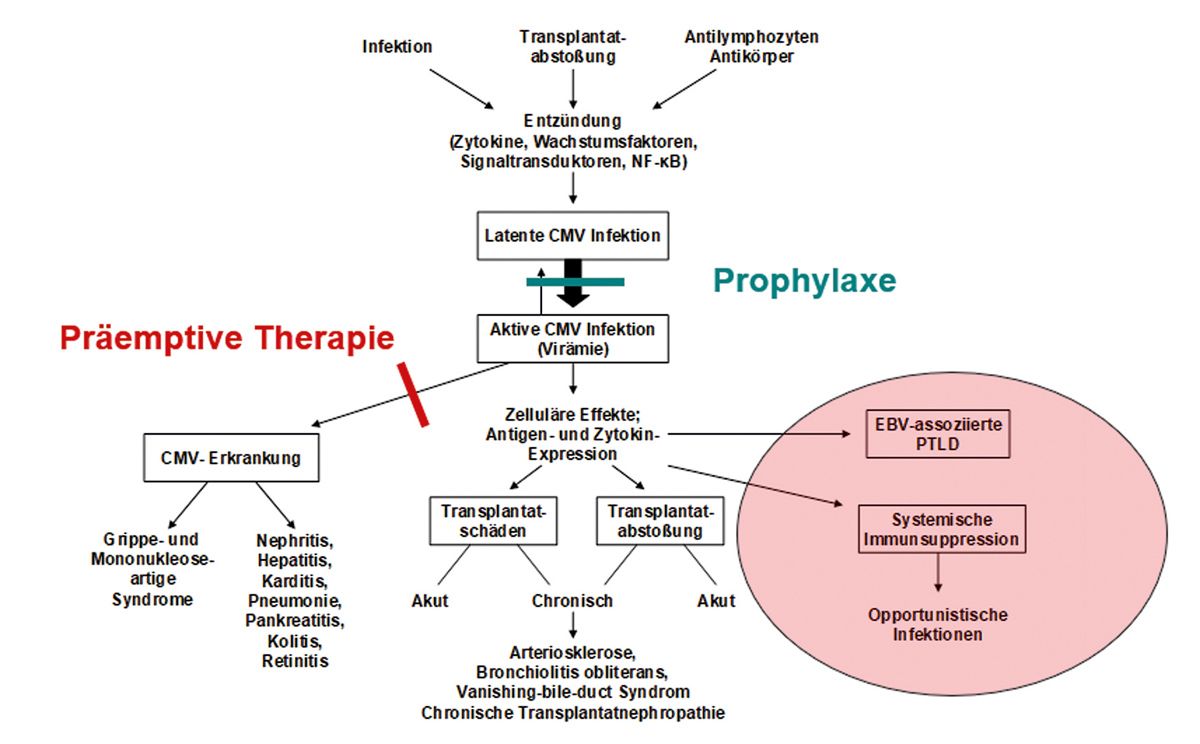
Wenn wir gesund sind, bekommen wir von diesem Virus nichts mit. Wenn unser Immunsystem gestört wird, kann dieses Virus Probleme bereiten. Es können klinisch manifeste Probleme auftreten, in dem Organe befallen sind. Dies ist zum Glück im heutigen Management sehr, sehr selten. Das Besondere am CMV-Virus ist ganz klar, dass auch eine sogenannte latente CMV-Infektion ein Problem darstellen kann. Das heißt, ich habe einen Nachweis dieses Virus in der PCR. Es kann eine ganze Reihe von Sekundäreffekten stattfinden, die noch nicht komplett verstanden sind.
Diese betreffen eine Modifikation des Immunsystems durch das CMV-Virus, was sich sein eigenes Environment schafft und zu vermehrten Infektionen, Transplantatabstößen und anderen Ereignissen wie EBV-assoziierten PTLDs führen kann. Die beiden grundsätzlichen Möglichkeiten der Prophylaxe sind die präemptive Therapie und eine direkte medikamentöse Prophylaxe. Wir werden darüber heute ganz viel sprechen. Wie sieht es bei der Stammzelltransplantation aus? Ich gebe dafür weiter an meinen Kollegen Herrn Teschner.
Dr. med. Daniel Teschner
Ich glaube, wir fangen mit den Soliden an.
00:43:35
CMV-Management nach Organtransplantation
Prof. Dr. rer. nat. Martina Sester
Wir fahren fort mit dem Management nach solider Organtransplantation. Sie sehen die zeitlichen Perioden, wann die Infektionen nach Organtransplantation auftreten.
In der Frühphase im ersten Monat haben wir es vorwiegend mit nosokomialen Infekten oder durch Spender übertragenen Erregern zu tun. In der Frühphase bis sechs Monate sind es hauptsächlich opportunistische Erreger. Dazu gehören die drei, die wir schon gehört haben. CMV zählt auch dazu. Nach mehr als sechs Monaten oder weitaus mehr als einem Jahr treten späte opportunistische Erreger und aus der Umgebung akquirierte Erreger und Infektionen auf. Die Kenntnis dieser Timeline, die im nächsten Bild gezeigt wird, hat natürlich Konsequenzen für die Planung von Impfungen, aber auch für das Screening, die Prophylaxe und die Therapie. Wir sollten wissen, in welchem Zeitfenster wir besonders auf diese Reaktivierung oder Infektion achten sollten.
Es ist hier eingeordnet. Sie sehen einige der Vertreter, die wir bereits vorhin gesehen hatten, HSV, VZV, hier reiht sich auch CMV ein, das ab Monat eins im ersten halben Jahr besonders häufig vorkommt. Sie sehen CMV-Infektionen durchaus jenseits des ersten Jahres. Diese späten Reaktivierungen sind die, um die wir uns heute speziell kümmern werden. Das Management der CMV-Infektionen ist eigentlich schon seit Jahren sehr schön in internationalen Guidelines hinterlegt.
Sie sehen hier die ganzen Aspekte, die in den Guidelines adressiert werden. Da es sehr viele Neuerungen im Gebiet der CMV-Infektionen gibt, welche wir diskutieren werden, findet gerade eine Aktualisierung dieser TTS-Guidelines statt. Sie werden im Juni 2024 in Montreal aktualisiert werden. Es laufen derzeit auch die Aktualisierungen der AWMF-Guidelines. Das alles können Sie derzeit in diesen Dokumenten und künftig in aktualisierten Dokumenten nachlesen. Was macht man diagnostisch? Man schaut natürlich auf klinische Symptome. So weit möchte man es jedoch nicht kommen lassen.
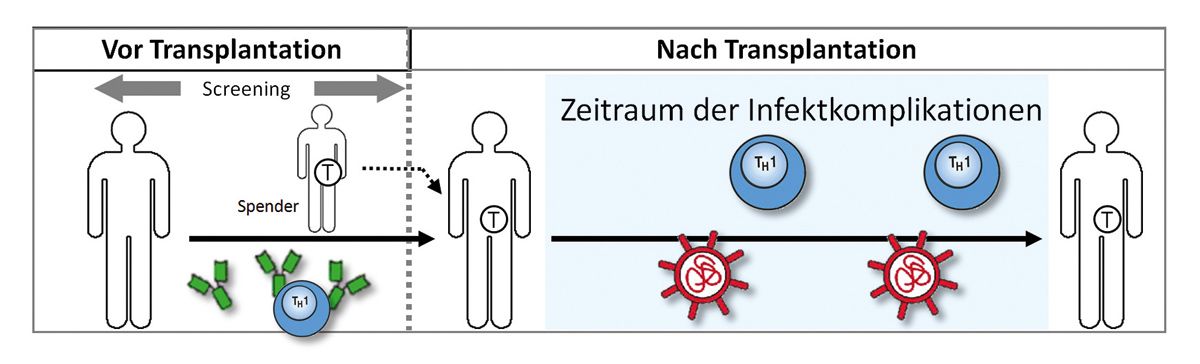
Man schaut zur Risikostratifizierung vorwiegend in der Frühphase oder vor der Transplantation auf Antikörper von Spender und Empfänger. Nach der Transplantation hat die Erregerlastbestimmung ihren Stellenwert und weniger die Antikörper. Man kann T-Zellen gegen CMV nachweisen, die man sowohl nach als auch vor Transplantation zur zusätzlichen Beurteilung des Risikos messen kann. Die Risikoabschätzung in Abhängigkeit des CMV-Infektionsstatus bei Organtransplantationen ist hier genannt. Sie hängt natürlich vom Serostatus des Empfängers und Spenders ab. Man spricht von einem hohen Risiko, wenn der Empfänger negativ und der Spender positiv ist. Man spricht von einem mäßigen Risiko bei positivem Empfänger und positivem oder negativem Spender. Das Risiko ist bei negativem Empfänger und Spender natürlich gering. Die Risikoeinschätzung ändert sich etwas, wenn Patientinnen und Patienten T-Zell-depletierte Therapien erhalten. Es werden hier mäßige Risikokonstellationen zu einem höheren Risiko, weil die zelluläre Immunantwort bei der Kontrolle des Virus eine besondere Rolle spielt.
Herr Teschner wird gleich auf die Situation bei Stammzelltransplantation eingehen. Die Risikobeurteilung ändert sich hier durch den Serostatus des Spenders und Empfängers, da wir von einer anderen Situation ausgehen. Das blutbildende System wird quasi ersetzt, ein positiver Empfänger trägt das Virus in sich, erhält aber ein negatives Transplantat. Man hat dann die höchste Konstellation vorliegen. Wir werden gleich mehr darüber hören. Die Risikoeinteilung erfolgt anhand der Serologie. Sollte man anhand der Serologie die Sorge haben, dass man es mit passiver Immunität zu tun hat, etwa durch Transfusionen oder mütterliche passive Immunität, kann man T-Zellen zur Bestimmung des Infektionsstatus heranziehen. Welchen Einfluss hat es? Wir haben die Möglichkeit, abhängig von der Konstellation eine antivirale Prophylaxe zu machen. Das kann in der Frühphase nach der Transplantation mit Valganciclovir oder Letermovir erfolgen. Es verhindert das Auftreten klinischer Symptome. Man hat jedoch das Risiko einer späten Infektion nach Absetzen der Prophylaxe. Bei der präemptiven Therapie liegt das Prinzip darin, dass man regelmäßig Viruslastmessungen durchführt und nur dann antiviral behandelt, wenn ein Hinweis auf eine Virusvermehrung vorliegt. Das kann eine Reaktivierung nach sich ziehen, wodurch man sehr eng kontrolliert durch ein engmaschiges Monitoring erneut behandeln muss.
Wir sehen hier zwei Optionen, die beide sehr gut geeignet sind, Infektionen oder Erkrankungen zu verhindern. Die konsequente Einnahme der Medikation ist auf Seiten der Prophylaxe wichtig. Das „A“ und „O“ auf Seiten der präemptiven Therapie ist die Durchführung eines konsequenten Monitorings der Viruslast, sonst sollte man sich nicht für eine präemptive Therapie entscheiden. Was sind die empfohlenen Strategien in den entsprechenden Konstellationen? Es gibt keine, in Anführungszeichnen, bei Niedrigrisikokonstellationen. Sie sollten allerdings bei klinischem Verdacht schnell reagieren. Bei den anderen Konstellationen, so sagen es die Guidelines, können Sie gleichermaßen Prophylaxe oder präemptive Therapie anwenden, vorausgesetzt die Medikation wird regelmäßig eingenommen beziehungsweise ein Monitoring wird konsequent durchgeführt. In der Realität würde man vielleicht behaupten, das können wir nachher diskutieren, dass die wahrscheinlich häufigere Situation diejenige ist, dass in allen drei Konstellationen entweder überall Prophylaxe durchgeführt wird, insbesondere wenn Patientinnen und Patienten weiter entfernt wohnen und nicht regelmäßig zum Monitoring kommen können, oder dass viele Zentren bei der Hochrisikokonstellation eine Prophylaxe und bei den Mäßigrisikokonstellationen eine präemptive Therapie machen. Das ist vielleicht die Realität.
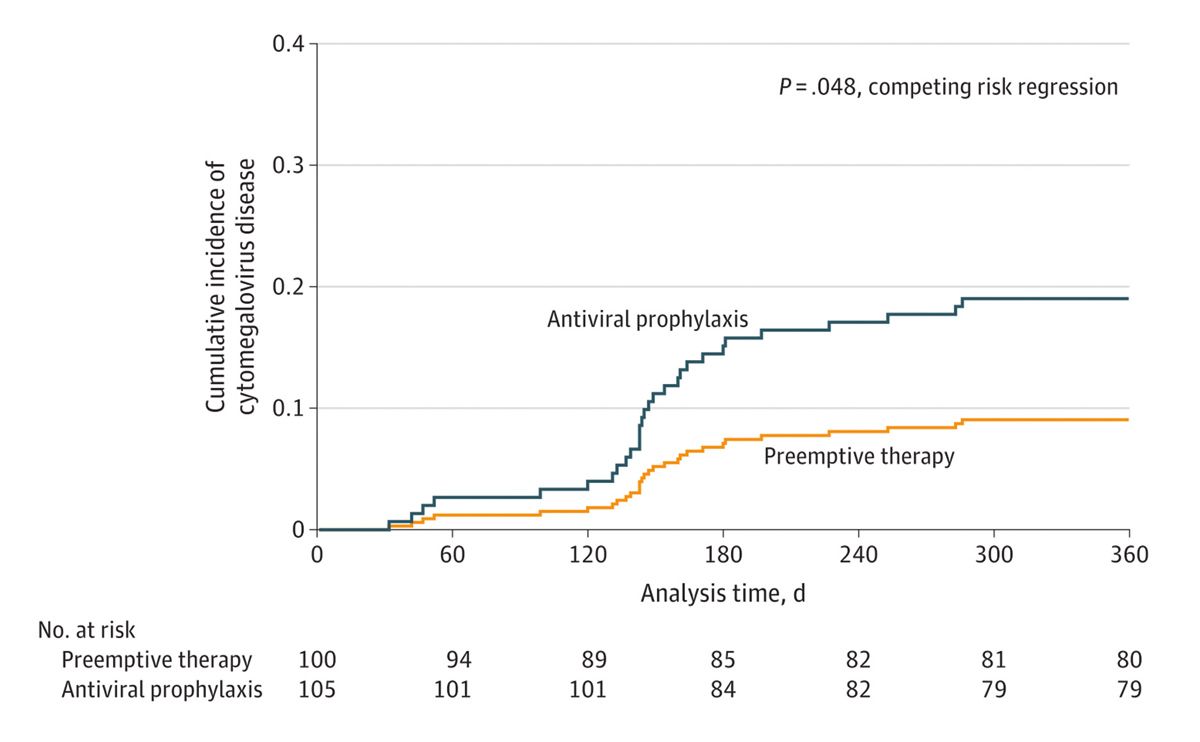
Was gibt es für Vor- und Nachteile dieser beiden Therapieformen? Beide sind mit guter Effizienz dazu geeignet, eine CMV-Erkrankung zu verhindern. Die Kosten sind unterschiedlich, in dem einen Fall bedingt durch die antivirale Medikation und in dem anderen Fall durch das Monitoring. Es hält sich in etwa die Waage. Wir schauen auf Komplikationen. Eine Komplikation der Prophylaxe ist die späte CMV-Erkrankung, die man nicht verhindern kann und die häufig in eine Periode fällt, in der die Immunsuppression nicht mehr so hoch ist. Dies ist eher seltener bei der Anwendung von präemptiver Therapie. Nebeneffekte insbesondere des Valganciclovirs oder des Ganciclovirs sind bei der Prophylaxe häufiger Leuko- oder Lymphopenien, die bei der präemptiven Therapie seltener auftreten. Die späten Erkrankungen nach Prophylaxe sind hier exemplarisch anhand einer Studie dargestellt.
Es sind Hochrisikokonstellationen, die randomisiert entweder mit Prophylaxe oder mit präemptiver Therapie behandelt wurden. Es traten tatsächlich unter Prophylaxe mehr Erkrankungen auf. Diese waren im Vergleich zur präemptiven Therapie später. Hier war wichtig, dass das präemptive Therapiemonitoring sehr engmaschig war. Man sollte sich sonst bei Hochrisikokonstellationen nicht für diesen Therapiearm entscheiden. Es war weiterhin in dieser Studie interessant, dass bei der präemptiven Therapie die zelluläre Immunität eher auf die Sprünge kam, vermutlich weil im Vergleich zur Prophylaxe häufiger Virusreaktivierungen beobachtet wurden. Dies ist ja das Konzept der präemptiven Therapie. Was sind die Risikofaktoren? Was passiert, wenn das Management nicht gelingt? Das sind die refraktären/resistenten Infektionen.
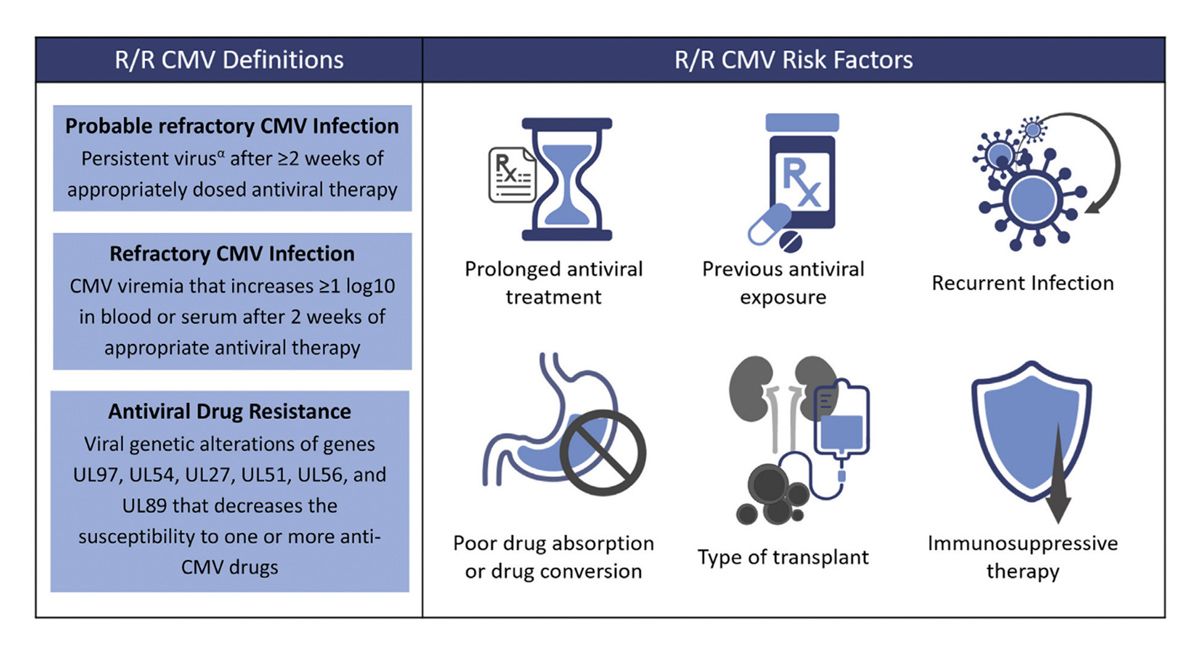
Das sind definitionsgemäß solche Infektionen, die über längere Zeit, mehr als zwei Wochen, nicht kontrolliert werden oder sogar ansteigen. Man spricht dann von einer wahrscheinlichen oder einer tatsächlichen refraktären Infektion. Kommt es darüber hinaus zu dem Nachweis einer Resistenz, spricht man von einer Resistenz. Es gibt hier besondere Herausforderungen, aber auch besondere Optionen, über die wir gleich sprechen werden.
Diesen refraktären/resistenten Infektionen ist oft eine unzureichende zelluläre Immunität gemeinsam. Was sind die Herausforderungen oder die Optionen, die wir haben? Wir können auf Seiten der Immunität über adaptiven T-Zell-Transfer, was wir gerade bei EBV gehört haben, oder die Gabe von Immunglobulin nachdenken. Wir haben auch Medikamente wie mTOR-Inhibitoren, die eine gewisse antivirale Aktivität haben. Das Foscarnet hat eine Nephrotoxizität. Es kommt bei Nierentransplantierten seltener zum Einsatz. Wir haben zwei relativ neue Medikamente. Wir haben das Maribavir.
Es ist für die refraktäre/resistente Infektion zugelassen. Wir werden das gleich hören. Wir haben das Letermovir, was schon länger bei Stammmzelltransplantierten und erst kürzlich bei Nierentransplantierten zugelassen wurden. Wir können auf Seiten des Monitorings über die zelluläre Immunität den Erfolg einer Therapie beurteilen. Die Wahrscheinlichkeit der langanhaltenden Kontrolle ist höher, wenn T-Zellen rekonstituieren, als wenn bei Absetzen der Therapie die Zellen noch nicht rekonstituiert sind. Das kann sicherlich für Langzeitmanagement und Relapse eine Rolle spielen. Ich möchte zusammenfassen, dass wir die Herausforderung haben, CMV-Infektionen und vor allem Reaktivierungen verhindern zu wollen. Wir möchten Resistenzen und eine Abschätzung der langfristigen Kontrolle ermöglichen. Wir können das durch neue antivirale Medikamente jetzt besser erreichen. Wir haben zusätzliche Möglichkeiten, Therapieformen und Immunmonitoring zur Individualisierung der Therapie zu nutzen. Ich darf an Herrn Teschner weitergeben. Jetzt kommt die Sicht der Stammzelltransplantation.
00:54:31
CMV-Management nach allogener HSZT
Dr. med. Daniel Teschner
Wir wechseln den Blickwinkel und gehen in die hämatopoetische Stammzelltransplantation mit dem Fokus auf das CMV-Management. Ich hatte Ihnen diese Abbildung bereits gezeigt. Das CMV spielt eine wesentliche Rolle und beschäftigt uns im Prinzip von Anbeginn der Stammzelltransplantation. Es tritt mittlerweile häufig eher später auf, als wir es in der Phase erlebt haben, als die Prophylaxe noch kein Standard war. Ein Risikofaktor aus Sicht der hämatopoetischen Stammzelltransplantation ist, dass der Empfänger das Virus in sich trägt und der Spender keine Immunität dagegen hat, sprich virusnaiv ist. Das heißt, bei uns spielen Reaktivierungen mit Abstand die primärste Rolle.
Wir haben im Vortrag zu der soliden Organtransplantation gehört, dass die Übertragung über das Organ relevant ist. Je nachdem, wie viel lymphatisches Gewebe übertragen wird, ist das Risiko höher, beispielsweise bei Lungen- oder Dünndarmtransplantationen. Bei uns ist es der Patient, der das Risiko in sich trägt. Das ist für uns der wesentliche Punkt. Die Frage ist, wie wir den Patienten vorbehandeln. Wenn wir ihn sehr intensiv myeloablativ konditionieren, haben wir das Problem, dass das Immunsystem deutlich länger braucht, um wiederzukommen. Die T-Zell-Depletion ist auch hier als Risikofaktor beschrieben. Die Ganzkörperbestrahlung, die Total Body Irradiation, ist ebenfalls beschrieben. Es wäre ein Risikofaktor, wenn wir spezielle Transplantationsmethoden anwenden, bei denen wir das Immunsystem stärker unterdrücken müssen, da es nur zur Hälfte passt, oder wenn wir Stammzellen aus Nabelschnurblut übertragen müssen. Das spielt in Deutschland praktisch keine und in Europa eine sehr geringe Rolle, da wir Gott sei Dank sehr viele Fremdspender haben. Es ist immer schlecht, wenn wir das Immunsystem zusätzlich unterdrücken, weil beispielsweise eine Transplantat-gegen-Wirt-Reaktion auftritt. Das Immunsystem des Spender, welches das Immunsystem des Empfängers wird, stellt fest, es ist in einer neuen fremden Umgebung und macht erst einmal Ärger. Das muss man abstellen. Darüber hinaus haben wir das Risiko der Reaktivierung. Dadurch, dass die Reaktivierung eine große Rolle spielt, ist das Wording in unserem Setting relativ wichtig. Wenn sie vor Stammzelltransplantation eine Primärinfektion hatten, entwickeln sie eine latente Infektion und können danach reaktivieren. Das bedeutet, sie müssen als Patient vor der Transplantation seropositiv sein, um reaktivieren zu können. Wenn sie seronegativ wären, könnten sie theoretisch eine Infektion erwerben. Das ist jedoch wirklich sehr selten. Frau Prof. Sester hat bereits erwähnt, dass sich aus dieser Reaktivierung die CMV-Erkrankung entwickelt, wenn wir das Virus tatsächlich im Organ nachweisen und eine klinische Symptomatik haben. Das ist der entscheidende Punkt. Wir haben davor Angst.
Bei Stammzelltransplantierten ist die CMV-Pneumonie am häufigsten. Das hier ist ein recht kürzlicher Fall bei uns in der Klinik. Wir haben eine junge Patientin mit einem Frührezidiv einer AML an eine CMV-Pneumonie verloren. Das heißt, man sieht es doch immer wieder. Eine CMV-Kolitis ist ebenfalls etwas, was immer wieder festgestellt wird. Es ist manchmal schwer, zwischen der schweren Graft-versus-Host-Disease im Darm mit CMV-Reaktivierung und der CMV-Kolitis zu trennen. Der Nachweis im Gewebe ist hier relevant. Wenn man konsequent schaut, sieht man ab und an CMV-Retinitiden. In einem Cluster in meiner alten, wundervollen Klinik in Mainz konnten wir CMV-Retinitiden häufiger beobachten, da wir eine sehr fitte Augenärztin in Mainz haben und hatten, die noch weiß, wie das aussieht. Es ist nicht weit vom Auge bis in das Gehirn. Eine CMV-Enzephalitis ist etwas, was gelegentlich leider Gottes vorkommt. Das ist ein Fall aus Mainz. Es ist eine sehr beeindruckende Patientin. Sie ist maximal symptomatisch, schwer komatös und mit wirklich nur ganz geringen Läsionen im MRT.
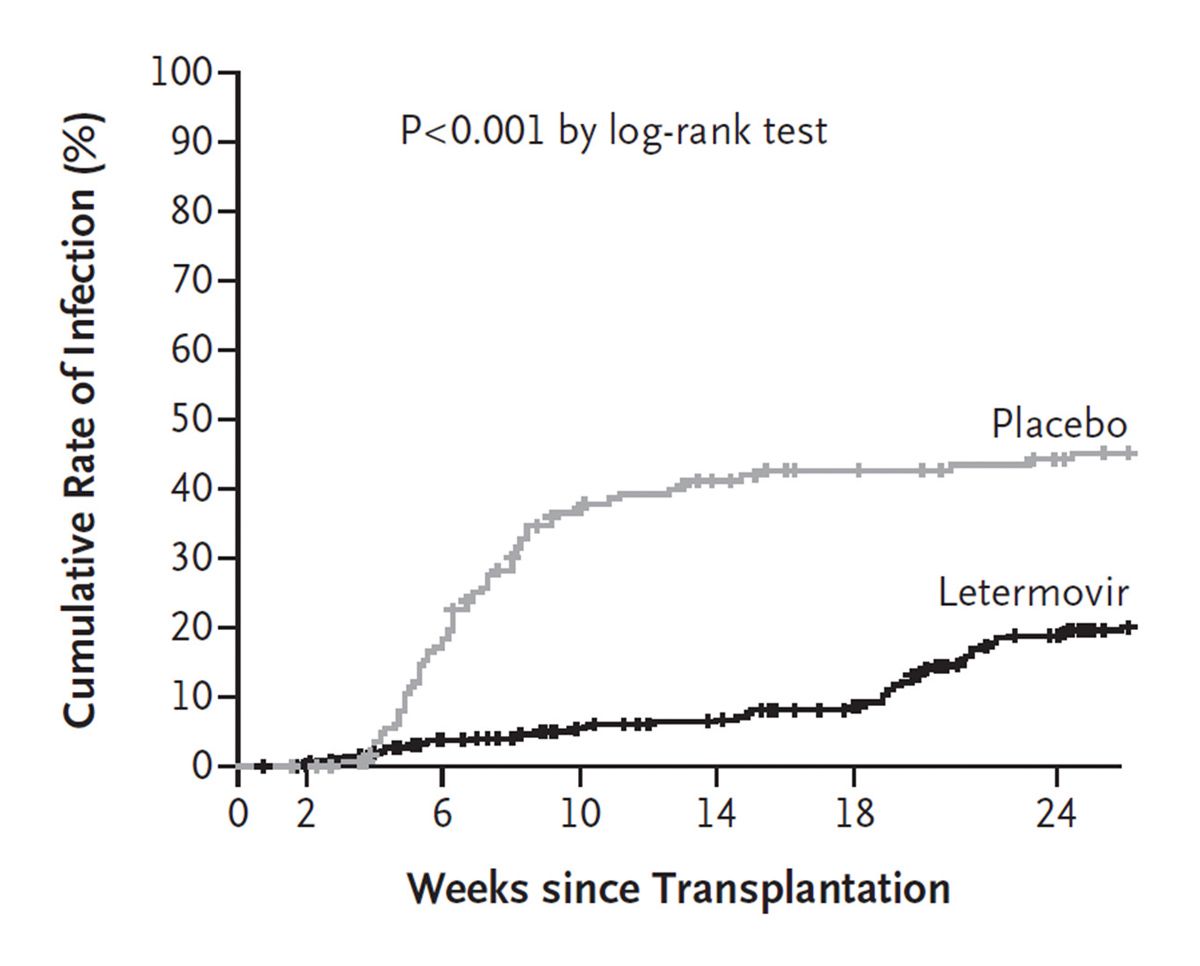
Es ist sehr beeindruckend, wie diskrepant die Befunde manchmal sind. Die Prophylaxe hat das Leben in der Stammzelltransplantation bezogen auf CMV massiv verändert. Die Kollegin hat es bereits angesprochen. Das Letermovir ist für die Stammzelltransplantierten schon vor ein paar Jahren eingeführt worden. Im Jahr 2017 wurde eine Phase-III-Studie publiziert, die Zulassung kam kurz danach. Wir haben davor im Prinzip nur präemptive Therapie gemacht, da bei unseren Patienten das Valganciclovir in der Prophylaxe zu toxisch ist. Man würgt das Knochenmark ab. Das frische, junge Transplantat hat dann wirklich Probleme. Die präemptive Therapie war deswegen der Standard. Es war Standard, dass ein großer Teil der Patienten regelmäßig auf Station behandelt werden musste, weil CMV reaktiviert hat. Es waren in etwa 50 %. Mit Letermovir ist das deutlich seltener der Fall. Hier sind die Daten der Zulassungsstudie.
Die Substanz wurde bis Tag 100 gegeben. Das entspricht Woche 14 in der Studie. Es ist in etwa Tag 100. Man sieht, die Wahrscheinlich der Reaktivierung ist signifikant weniger als unter Placebo. Sie müssen monitoren, um tatsächlich detektieren zu können, dass eine Reaktivierung stattfindet. Das haben wir bereits im Rahmen der Herpesviridae besprochen. Wir monitoren auch relativ viel nach der allogenen Stammzelltransplantation.
In diesem Fall geht es um CMV. Das macht man mittels PCR aus dem Plasma. Man weist das Virusgenom im wöchentlichen Abstand nach, so wie es Frau Prof. Hilgendorf beschrieben hat. Man muss leider sagen, spätestens wenn eine Transplantat-gegen-Wirt-Reaktion vorliegt und sie mit Steroiden anfangen, ist die Wahrscheinlichkeit sehr hoch, dass sie CMV-DNA nachweisen, es zur Reaktivierung kommt und sie präemptive Therapie machen müssen. Sie haben bei der Erstlinientherapie ein Stück weit die Wahl zwischen Pest und Cholera, was das Nebenwirkungsprofil angeht. Sie wirken alle gegen das Virus. Sie können sich aussuchen, ob sie das Knochenmark oder die Niere belasten. Ein weiterer Nachteil ist, dass die Substanzen primär nur i.v. verfügbar sind. Es ist daher häufig mit einer Hospitalisierung verbunden.
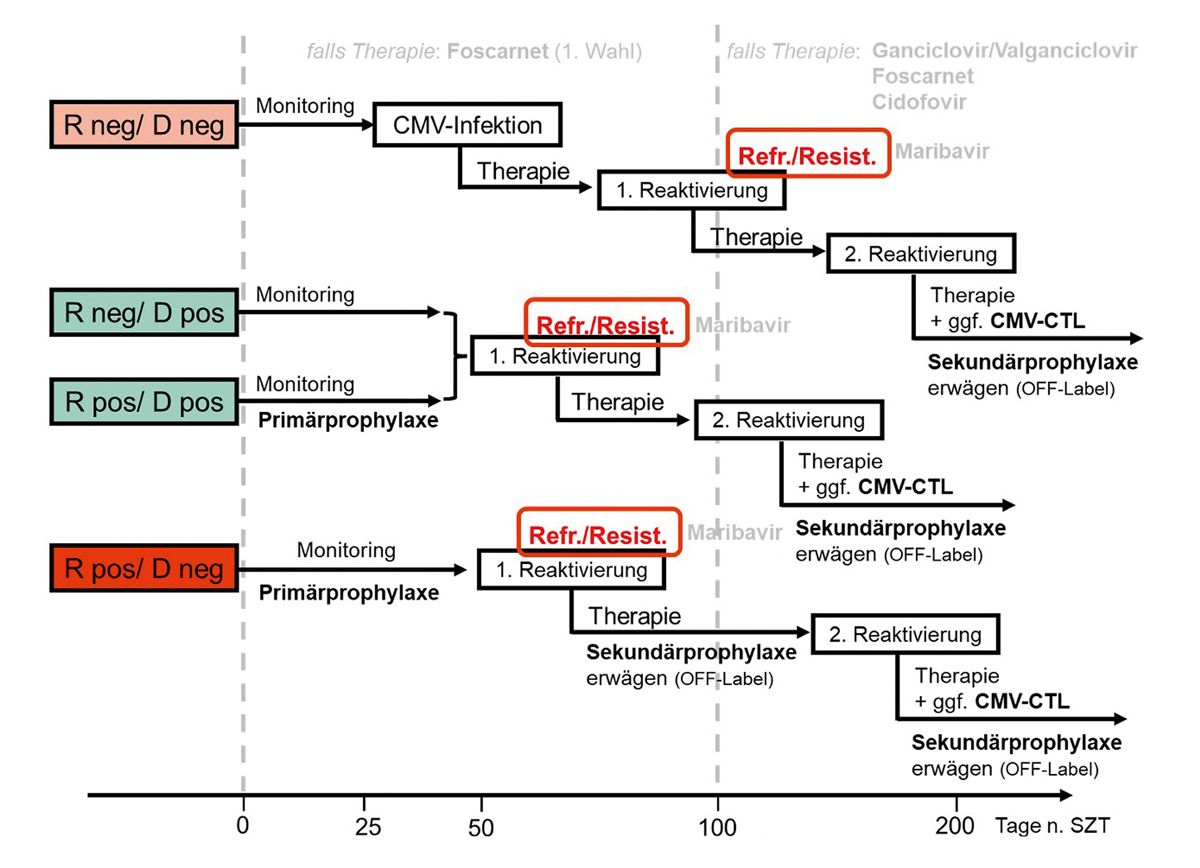
Wenn man das für die Fremdstammzelltransplantation zusammenfasst, haben wir hier vorne die Risikogruppen. Das sind Patienten, die das Virus nicht in sich tragen und dementsprechend maximal eine Infektion bekommen können. Das ist, wie gesagt, sehr selten. Die Patienten, die das Virus in sich tragen und positiv sind, können reaktivieren. Es kann seltener durch das Transplantat übertragen werden. Bei Empfängerpositivität ist die Primärprophylaxe der Standard.
Bei einer ersten Reaktivierung in der Phase, in der das Transplantat noch relativ wackelig ist, ist meine Empfehlung, primär mit dem Foscarnet zu arbeiten, da die Niere häufig stabiler als das Knochenmark ist, und erst nach hinten heraus Ganciclovir einzusetzen. Sie haben im Prinzip in der Erstlinien die erste per os-Substanz, die Sie erst dann geben können, wenn das Transplantat etwas stabiler geworden ist. Wenn das Virus nicht macht, was es soll, nämlich negativ werden, haben Sie eine refraktäre Situation und können das Maribavir einsetzen.
Es ist per os verfügbar. Das heißt, die Patienten müssen nicht auf Station bleiben oder gar nicht erst aufgenommen werden. Die Frage ist, was Refraktärität ist. Man orientiert sich relativ eng an den Empfehlungen von unter anderem Roy Chemaly et al. oder an dem Studienprotokoll der Zulassungsstudie. Wenn Sie innerhalb von zwei Wochen unter suffizienter virusstatischer Therapie keinen adäquaten Abfall der CMV-Viruslast beobachten, haben Sie eine refraktäre Situation. Sie sind dann meines Erachtens voll im Label und sollten auf die wirksame und wenig toxische Substanz setzen. Man findet selten Resistenzen, ähnlich wie bei HSV. Das Problem liegt in der Awareness und der Testhäufigkeit. Es dauert relativ lange. Es können nicht viele Labore durchführen. Wenn eine Resistenz vorliegt, haben Sie über den anderen Wirkmechanismus, über das andere Enzym eine gute Wirksamkeit von Maribavir gegenüber den anderen Substanzen. Sie können das Immunsystem nutzen, die Kollegin hat bereits darüber berichtet, um zu monitoren, ob es wiederkommt. Die Zellen zeigen uns an, was im Patienten passiert. Sie können T-Zellen geben. Die Steuerung der Therapie ist ein wichtiger Punkt. Wie lange muss man es geben? Wir haben über Jahrzehnte die Erfahrung gemacht, dass Sie gut absetzen können, wenn die PCR zwei Mal negativ ist. Sie sollten aber im wöchentlichen Abstand messen. Die Genetik ist nicht so schnell. Wenn eine CMV-Erkrankung vorliegt, was Gott sei Dank nicht mehr so häufig ist, aber immer wieder vorkommt, ist es zwar schön, wenn die CMV-PCR negativ ist, aber Sie sollten auf jeden Fall darauf achten, dass die Symptome, die klinischen Zeichen weg sind. Der Patient ist krank. Es ist keine Reaktivierung. Es ist eine Erkrankung. Awareness ist wichtig. Vorsichtig sein, messen, Reaktionsmechanismen vordefinieren. Insgesamt ist es jedoch nichts, weswegen man panisch sein muss. Es ist ein Virus, was wir in der Transplantationsmedizin seit vielen, vielen Jahren kennen. Es ist natürlich schön, wenn wir jetzt mehrere oder neue Werkzeuge haben, um sowohl in der Prophylaxe als auch in der Therapie besser damit umgehen zu können. Mit diesem Slide wechseln wir wieder in die SOT. Oliver, Du wirst uns etwas zu der Substanz erzählen.
01:04:11
Neues zu Infektionen nach Organtransplantation Teil 2
Prof. Dr. med. Oliver Witzke
Wir kommen zu den kompliziertesten Fällen. Ihr habt gesagt, dass die Standardfälle gut mit Prophylaxe, präemptiver Therapie und einem guten Monitoring angegangen werden können. Die refraktären/resistenten CMV-Infektionen, über die wir gerade gesprochen haben, machen um die 3 % bis maximal 5 % der Fälle aus. Es ist ein seltenes Ereignis. Es ist ein Ereignis, welches nach wie vor bedrohlich ist. Wir haben in dieser fast verzweifelten Situation neue Optionen.
Die Fälle refraktär/resistent sind klinisch sehr relevant, selbst wenn sie in sich asymptomatisch sein können. Es konnte in einer Vielzahl von Studien ganz klar gezeigt werden, dass sie mit einem sehr, sehr schlechten Outcome vergesellschaftet sind. Hospitalisationen, Transplantatverluste, Mortalität. Das passiert über die Mechanismen, die ich anfangs angerissen hatte und die letztendlich noch nicht ganz klar sind. Hier ist die entscheidende Publikation, die die Definition von refraktär und resistent geliefert hat. Ich kann wirklich dazu auffordern, dass man die Resistenztestung in Gang bringt, sobald Sie sehen, dass ein CMV-Infekt nicht wie erwartet verläuft und die Viruslast sich nicht verringert. Ich würde sagen, man findet bei der soliden Organtransplantation einigermaßen regelmäßig die Situation einer Resistenz. Die Situation ist sonnenklar. Man soll die Substanz, die gar nicht wirken kann, nicht mehr nehmen. Man muss die Pferde wechseln. Ich möchte Ihnen die entscheidende Studie vorstellen, welche die neue oral verfügbare Substanz Maribavir in die Klinik und zur Zulassung gebracht hat.
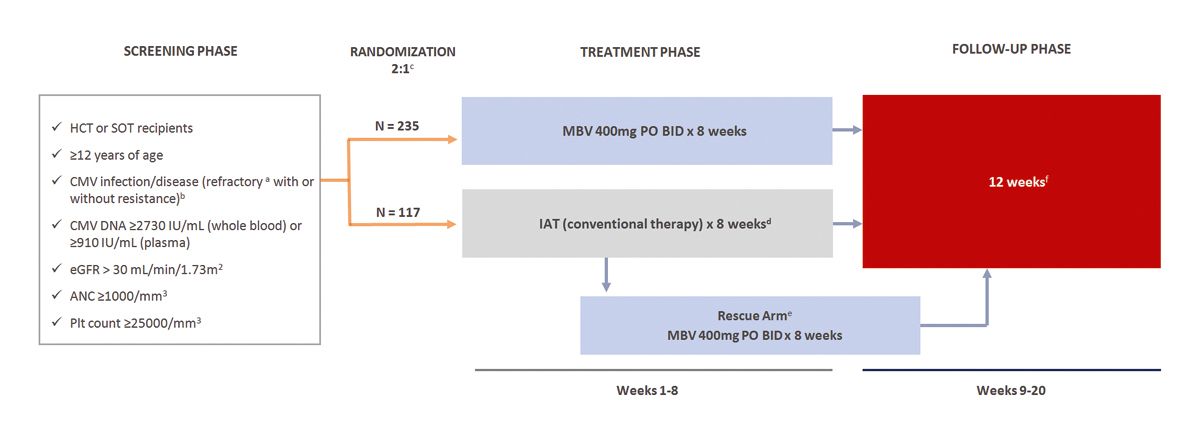
Es ist eine Phase-III-Studie gewesen, in die sowohl organtransplantierte Patienten als auch stammzelltransplantierte Patienten eingeschlossen werden konnten. Sie mussten eine resistente oder refraktäre CMV-Infektion und weitere Kriterien aufweisen. Es wurde in zwei Armen verglichen.
Es gab einen Maribavir-Arm, für den die Therapie über 8 Wochen durchgeführt wurde. Es gab einen konventionellen Therapiearm, der eben- falls über 8 Wochen durchgeführt wurde und in der Regel Foscarnet oder hochdosiertes Ganciclovir enthielt. Es ist aus ethischen Gründen in das Studienprotokoll eingearbeitet worden, dass es die Option zum Wechsel auf Maribavir gab, wenn dieser Arm nicht funktionierte oder Probleme wie Toxizität auftraten. Es ist sehr wichtig, dass diese Therapie für die Interpretation der Ergebnisse nach acht Wochen gestoppt werden mussten. Wir schauen uns die Ergebnisse an.
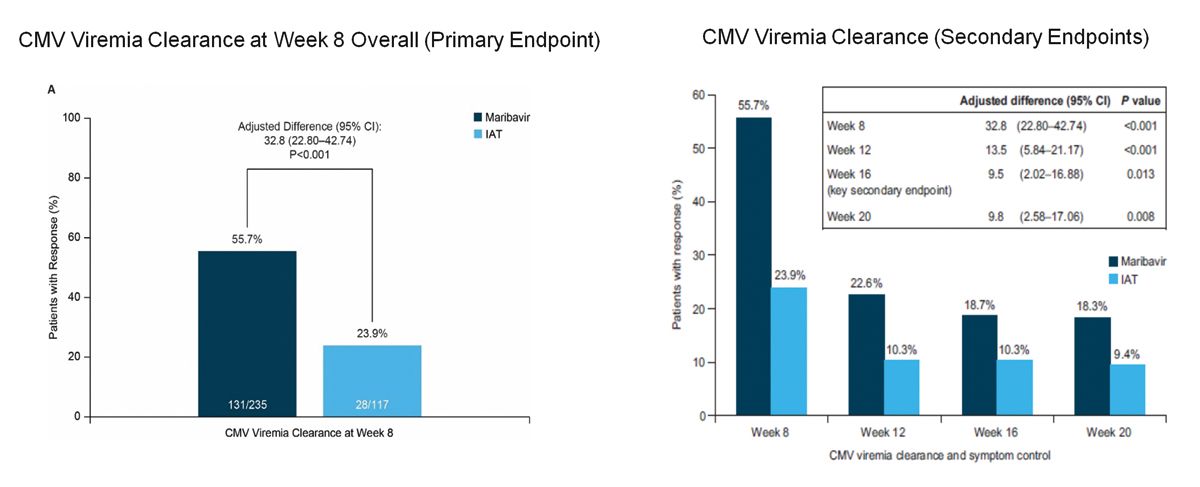
Es gibt ein klares primäres Ergebnis. Der Erfolg bei den Maribavir-Patienten beträgt 55 %. Das CMV-Virus war nach 8 Wochen, nach Ende des Therapieintervalls verschwunden. Dies steht im Gegensatz zu unter 25 % in dem Vergleichsarm. Es ist ein sehr, sehr hoher, signifikanter Unterschied. Ich muss erwähnen, dass bei 45 % der Patienten das Problem nicht gelöst wurde. Wir schauen uns die ganze Sache weiterführend an. Wir verfolgen weiter, was bei den Patienten in der Studie passiert ist. Bitte behalten Sie im Blick, dass die Therapie nach 8 Wochen gestoppt wurde. Wir sehen, dass ein Großteil der Patienten ein Rezidiv erlitten hat.
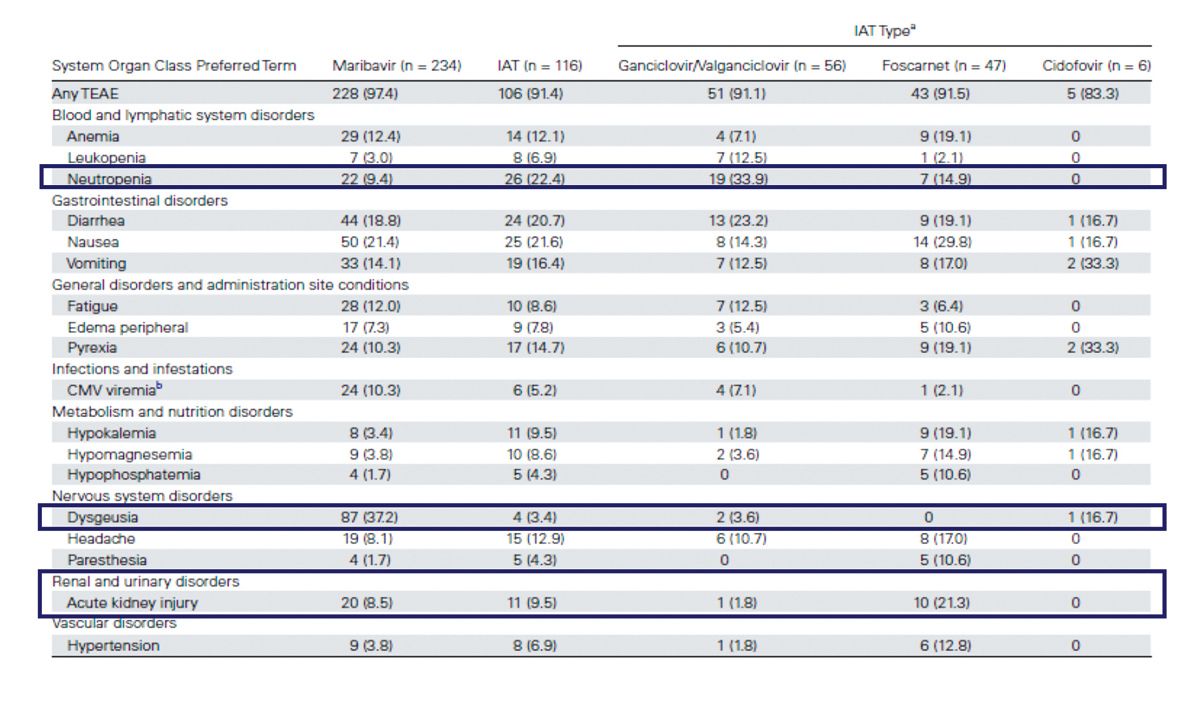
Es ist nur ein kleiner Teil der Patienten nach 16 Wochen virusfrei geblieben. Dies zeigt die Komplexität dieses Patientengutes. Es sind die schlechtesten der schlechten Patienten, die ganz schlecht eine Immunität aufbauen können, sodass wir über die neue Substanz hinaus Strategien brauchen, um mit dieser Situation umzugehen. Wir hatten die beiden Gruppen, die Stammzelltransplantierten und die Organtransplantierten, betrachtet. Es hat sich bei den Organtransplantierten aufgeteilt in verschiedene Organe. Ich mache es kurz. Es hat keine Rolle gespielt, was der Patient für eine Grunderkrankung oder Grundtransplantation hatte. Das Konstrukt hat letztlich immer funktioniert. Ein weiterer sehr, sehr wichtiger oder entscheidender Punkt ist das Nebenwirkungsprofil der neuen Substanz im Vergleich zu den bekannten Substanzen.
Man sieht, dass bei Maribavir eine Geschmacksstörung, die reversibel ist, das Hauptproblem ist. Bei Foscarnet beziehungsweise bei Ganciclovir hat die Nephrotoxizität beziehungsweise die Knochenmarktoxizität zu relevanten Problemen und häufig zu einem Therapieabbruch geführt. Wir haben am Ende einen Effektivitätsunterschied, aber auch einen ganz klaren Nebenwirkungsunterschied gesehen, was letztlich zu der Zulassung von Maribavir für diese refraktäre/resistente Situation geführt hat.
Ich möchte das Studienprotokoll zusammenfassen. Wir haben die neue Substanz. Wir müssen klären, wie wir den 45 % der Patienten helfen können, die auch auf diese Substanz anfangs nicht reagieren. Wir müssen uns gut überlegen, was wir nach diesen 8 Wochen machen. Sind 8 Wochen der richtige Zeitraum oder müssen wir länger therapieren? Brauchen wir vielleicht eine Rezidivprophylaxe oder eine Kombinationstherapie? Ich möchte es, um es klarer zu machen, anhand eines klinischen Falls zeigen. Es ist die erste Patientin, die wir in Essen mit dem Maribavir behandelt haben. Es ist eine Patientin, die ich sehr gut kenne. Sie wird ungefähr so lange, wie ich dort tätig bin, in dem Transplantationszentrum betreut. Ich bin in den 90er Jahren in das System gekommen. Sie hatte zwei Nierentransplantate, die aufgrund der Grunderkrankung, ein aHUS, nicht erfolgreich gewesen waren. Sie konnte 2016, nachdem eine Therapie für die Grunderkrankung verfügbar war, zum dritten Mal transplantiert werden. Man ahnt, dass es einen komplizierten Verlauf genommen hat. Sie hat viele opportunistische Infektionen bekommen. Sie hat einen schweren zellulären und einen humoralen Immundefekt. Wie so oft, wenn es Unglück gibt, kommt CMV dazu. Sie brauchte lange Valganciclovir in wechselnden Dosierungen. Sie hat immer wieder Rekurrenzen bekommen, dieses Mal auch mit Klinik, und hat die Medikation letztlich schlecht vertragen. Es musste nach einer Resistenztestung von Valganciclovir auf Foscarnet umgesetzt werden. Es gab eine dringende klinische Notwendigkeit mit einer schweren symptomatischen CMV-Kolitis. Es gab zu allem Unglück ein akutes Nierenversagen und eine Abstoßung. In der Situation hätte man eigentlich gedacht, dass es zu viel des Guten ist und es keine Option mehr gibt. Wir hatten eine Option. Das Maribavir ist so gerade eben verfügbar gewesen. Wir konnten den CMV-Infekt gut eingrenzen, was uns erlaubt hat, die Abstoßungsreaktion durch Erhöhung der Immunsuppression durch Steroide zu behandeln. Es ist zunächst einmal alles gut geworden. Sie können sich vorstellen, dass sich diese Geschichte mit dieser Patientin bis in das Jahr 2024 fortsetzen könnte. Man hat natürlich zunächst einen Erfolg, eine Option gehabt. Ich verrate hier, dass es nicht einfach gewesen ist, weitere Rekurrenzen zu vermeiden. Das Thema ist mit diesem Therapiezyklus nicht zu Ende gewesen. Nicht nur diese Patientin hat einen zweiten Zyklus mit Maribavir benötigt. Es hat nahezu alle Patienten betroffen, die ich bislang in dieser Kondition betreut habe. Es ist klar, dass wir weitere Strategien brauchen, um mit diesen komplexen Infektionen umzugehen. Wir haben aber mit der neuen Substanz einen großen Fortschritt gemacht. Ich darf weitergeben an eine weitere Kasuistik zur Stammzelltransplantation.
01:12:47
Patientenkasuistik – Refraktäre CMV-Infektion nach allogener HSZT
Dr. med. Daniel Teschner
Zum Schluss zeige ich ein ähnliches Beispiel von einem Blutstammzelltransplantierten. Ich finde es spannend, dass Du auch in Deiner Klinik von Deinem Arbeitgeber betreut wirst. Das ist der Fall. Es ist ein junger Mann, 23 Jahre alt, der ursprünglich eine common B-ALL hatte. Sie hören bereits heraus, es ist insgesamt gut gegangen. Er wurde in Armenien erstdiagnostiziert. Er ist dort mit einer Hochrisikokonstellation detektiert worden und hat primär ein pädiatrisches Protokoll erhalten, da er damals minderjährig war. Er ist in eine komplette Remission gekommen. Er hatte in Armenien leider ein Rezidiv. Er hat ein Protokoll für Erwachsene bekommen, welches aus Deutschland kommt. Er hat eine zweite Remission erreicht. Es ist eigentlich klar, dass diese Patienten stammzelltransplantiert werden müssen, damit sie eine möglichst gute Chance auf eine Langzeitheilung haben. Das ist in Armenien nicht möglich. Er ist deswegen nach Deutschland geflüchtet, um dort ein kuratives Anschlusskonzept bekommen zu können. Ich habe ihn in wirklich schlechtem Zustand kennengelernt. Er kam in einem Rollstuhl hereingefahren. Er hatte starke Knochenschmerzen. Er hatte keine aktive Infektion. Er war CMV-IgG im Serum positiv. Das ist in dem Alter nicht so häufig, muss man sagen. Wir sehen in Europa eine starke regionale Verteilung. Er war ganz alleine in Deutschland, hatte keine Eltern oder Geschwister dabei. Er sprach nur armenisch, kein russisch und kein englisch. Er hat in Armenien gearbeitet und eine abgeschlossene Ausbildung gehabt. Er hatte also eine gute, wenn man so will, Sozialprognose. Es war am Anfang wirklich sehr schwer für den jungen Mann. Wir haben zunächst geschaut, was überall an Erkrankung da ist, wenn überhaupt. Wir haben eine Fremdspendersuche gemacht und die Stammzelltransplantation geplant. Wir haben leider keinen optimalen Spender gefunden, sondern einen Spender mit nur acht von zehn Übereinstimmungen auf der Oberfläche der Leukozyten. Wir haben für ihn eine haploidente Stammzelltransplantation geplant und ihn konditioniert. Das Ganze hat im September des vergangenen Jahres stattgefunden. Man benutzt Protokolle mit post-Transplant Cyclophosphamid. Das erwähne ich nur nebenbei. Wir sind bei den Prophylaxen, wir haben es bereits besprochen, recht großzügig. Es gibt Aciclovir bei HSV- und auch VZV-Positivät. Wir geben Posaconazol, um Schimmelpilzinfektionen zu vermeiden. Wir geben das Letermovir, welches ich schon vorgestellt hatte, und später das Cotrim, um Toxo oder PCP zu verhindern. Das Transplant ist gut gelaufen. Er kam in die Nachsorge, hat aber leider eine akute GvHD, eine Graft-versus-Host, Transplantat-gegen-Wirt-Reaktion entwickelt. Die Haut war zu 70 % sehr rot. Es kamen Übelkeit, Erbrechen, Durchfall und starke Schmerzen dazu. Es hat sich im Verlauf ganz klar gezeigt, dass eine schwere Abstoßungsreaktion mit Gesamtschweregrad vier vor- liegt. Das bedeutet, wir mussten ihn aufnehmen und die Immunsuppression eskalieren. Es gab Cortison, systemisch und topisch, Ruxolitinib und eine intensive supportive Therapie. Es wurde eben bereits formuliert, wenn eh schon alles schlimm ist, kommt CMV dazu. Der arme Mann war auf Station, wurde dreifach immunsupprimiert behandelt und wir haben Ganciclovir für die CMV-Reaktivierung geben. Das sehen Sie hier in schwarz. Die Nierenfunktion ist blau, die Leukozyten und die Thrombozyten sind unten angegeben. Die Viruslast stieg zunächst an. Das ist nicht so ungewöhnlich, aber dadurch, dass er eine so schwere Abstoßung hatte, hat er all seine Immunglobuline in seinem Blut verbraucht. Wir haben uns daher hinreißen lassen, ihm CMV-spezifische Immunglobuline zu geben. Wir konnten tatsächlich die Immunsuppression ein wenig reduzieren, da die Graft-versus-Host-Disease besser wurde. Das hat dem CMV gut getan, da wir das CMV zurückgedrängt haben. Da er schon eine Weile im Krankenhaus war, war das Ziel, ihn nach Hause zu bringen. Wir haben auf Valganciclovir per os umgestellt. Das Elend ging wieder los. Die CMV-PCR ist wieder angestiegen. Es war im Prinzip eine refraktäre Situation. Wir haben über das Maribavir in der Situation natürlich sofort nachgedacht. Wir hatten zu dem Zeitpunkt die Schwierigkeit, dass er quasi noch stationär war und es noch kein NUB, noch kein ZE oder ähnliches gab. Es war abrechnungstechnisch durchaus eine Herausforderung. Wir haben das Ganze konsequent in das ambulante Setting umgeplant. Wir haben ein Portsystem implantieren lassen und nach der Entlassung direkt mit Maribavir per os angefangen. Wir konnten Gott sei Dank die Immunsuppression ein wenig reduzieren. Das CMV-Virus ist unter dem Maribavir und der niedrigeren Immunsuppression gestürzt. Es ist unten geblieben. Wir haben es nach zwei Wochen negativer PCR abgesetzt. Es blieb in unserem Fall dabei. Das lag sicherlich auch daran, dass wir parallel die Immunsuppression weiter reduzieren konnten. Es ging dem Patienten deutlich besser. Er wollte von der Nadel weg. Wir haben die parenterale Ernährung reduziert. Das hat der Niere nicht ganz so gut getan, aber das hat er in Kauf genommen. Es geht ihm gut. Er hat es gut überstanden. Er muss noch etwas an Gewicht zunehmen. Wir sind aktuell dabei, ihn dabei zu unterstützen, eine Arbeitsstelle zu suchen. Es ist eine Erfolgsgeschichte. Es war sicherlich dadurch bedingt, dass wir auf eine Substanz mit deutlich weniger Nebenwirkungen wechseln konnten.
Q & A
Prof. Dr. rer. nat. Martina Sester
Vielen Dank, Herr Teschner, für den schönen Fallbericht. Welche Informationen gibt es zu Maribavir-Resistenzen aus den Studien? Haben Sie damit bereits Erfahrungen gemacht?
Prof. Dr. med. Oliver Witzke
Ich hatte in der Studie gezeigt, dass 45 % der Patienten nicht auf die 8-wöchige Maribavir-Therapie in dieser sehr komplizierten Situation angesprochen haben. Es sind Patienten, die oft vorweg Resistenzen gegen andere Substanzen hatten. Bei einem relevanten Teil der Patienten, die nicht angesprochen haben, hat es tatsächlich Maribavir-Resistenzen gegeben. Es ist klar. Wir wissen in der Infektiologie und Virologie, dass es immer Thema ist, dass ein komplexes Virus, welches man mit einer Monotherapie behandelt und welches schon vorher Resistenzen hat, weitere Resistenzen entwickeln kann. Die gibt es und man kann sie auch nachweisen.
Dr. med. Daniel Teschner
Wobei das natürlich ein Studiensetting war. Es wurde jeder Patient getestet. Es wurde sehr genau geschaut. Es gibt sie, genau wie bei den anderen Substanzen auch.
Prof. Dr. rer. nat. Martina Sester
Ich darf herzlich danken. Frau Rieger, haben Sie noch eine Frage?
Prof. Dr. med. Christina T. Rieger
Ich wollte mich auch sehr, sehr herzlich für Ihre tollen Beiträge bedanken. Alle drei Übersichtsvorträge waren super. Vielen Dank.
Referenzen
- Anton-Vazquez V et al. J Clin Virol 2020; 128:104421.
- Hagel S et al. Crit Care 2020; 24: 584.
- Blennow O et al. Biol Blood Marrow Transplant 2014; 20:1646-9.
- Hügler P et al. Eur J Pain 2002; 6:435-45.
- Lee CJ et al. Biol Blood Marrow Transplant 2018; 24:1783-1787.
- Odumade OA et al. Clin Microbiol Rev 2011; 24:193-209.
- Lee M et al. Curr Oncol Rep 2023; 25:883-895.
- Opelz G. Am J Transplant 2004; 4:222-30.
- Fishman JA et al. N Engl J Med 1998; 338:1741-175.
- Agrawal A et al. Clin J Am Soc Nephrol 2022; 17:286-295.
- Singh N et al. JAMA 2020; 323:1378-1387.
- Khawaja F et al. Clin Microbiol Infect 2023; 29:44-50.
- Marty FM et al. N Engl J Med 2017; 377:2433-2444.
- Avery RK et al. Clin Infect Dis 2022; 75:690-70.
Bildquellen
Titel © mi_viri – stock.adobe.com




Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der arztCME-Online-Akademie erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.